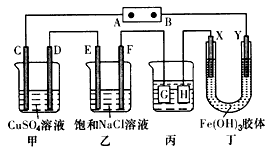
1、选择题 如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
[? ]
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,相同时间内,生成各单质的物质的量之比为1:2:3:2
C.欲用丙装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.丁装置中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
参考答案:C
本题解析:
本题难度:一般
2、选择题 右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,合这一情况的是
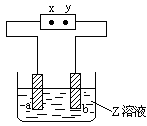
| a极板
| b极板
| x电极
| Z溶液
|
A
| 锌
| 石墨
| 负极
| CuSO4
|
B
| 石墨
| 石墨
| 负极
| NaOH
|
C
| 银
| 铁
| 正极
| AgNO3
|
D
| 铜
| 石墨
| 负极
| CuCl2
|
参考答案:A
本题解析:通电后发现a极板质量增加,说明a电极是阴极,则X是电源的负极。b极板处有无色无臭气体放出,则b电极是阳极,溶液中的OH-放电,生成的气体是氧气,所以符合条件的是选项A,答案选A。
考点:考查电化学的综合应用和判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,侧重对学生能力的培养和方法、技巧的指导。该题的关键是明确电解池中阴阳离子的放电顺序,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
[? ]
A.NaCl溶液?
B.HCl溶液?
C.NaOH溶液?
D.AgNO3溶液
参考答案:C
本题解析:
本题难度:一般
4、填空题 (12分)Cl2及其化合物在生产、生活中具有广泛的用途
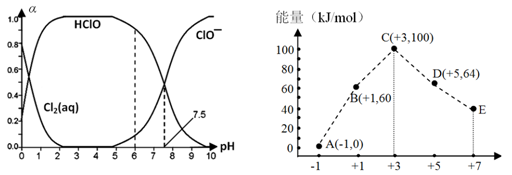
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如左上图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果强的是__________。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为
______________________________________________________________。
(2)ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式____________。
(3)工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,NaClO3在_____极(填阴或阳)生成,生成ClO3
参考答案:
本题解析:
本题难度:困难
5、填空题 (6分)
(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3—。两步反应的能量变化示意图如下:
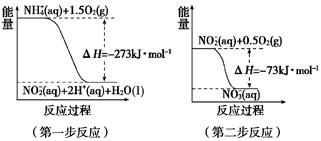
1 mol NH4+ (aq) 全部氧化成NO3—(aq)的热化学方程式是_______________。
(2)、电解NO制备 NH4NO3,其工作原理如图所示,
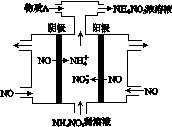
写出该电解池的电极反应式
阳极: __________________________ 阴极:________________________________
参考答案:(1)NH4+ (aq)+2O2(g)===2H+(aq)+NO3—(aq)+H2O(l) ΔH=-346 kJ·mol-1 (2分)
(2) 阳极:NO-3e-+2H2O=== NO3—+4H+ (2分)
阴极:NO+5e-+ 6H+=== NH4++ H2O (2分)
本题解析:由盖斯定律可知1 mol NH4+ (aq) 全部氧化成NO3—(aq)的反应热为ΔH=—273 kJ·mol-1+(—73 kJ·mol-1)="—346" kJ·mol-1,则其热化学方程式为NH4+ (aq)+2O2(g)===2H+(aq)+NO3—(aq)+H2O(l) ΔH=-346 kJ·mol-1;电解NO制备 NH4NO3,根据工作原理图可知阴极为NO放电,产物为NH4+,阳极为NO放电,产物为NO3—,故其阴极电极反应为NO+5e-+ 6H+=== NH4++ H2O,阳极电极反应为NO-3e-+2H2O=== NO3—+4H+。
考点:盖斯定律与电化学原理
本题难度:一般