1、简答题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.请回答下列问题:
(1)E的电子式为______.
(2)反应③的离子方程式为______.
(3)F与G的溶液反应的化学方程式为______.
(4)检验溶液L中金属阳离子的方法是______.
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为______(此分子式中元素符号书写次序按从左往右元素原子序数“大小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为______.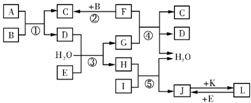
参考答案:C、D均能使澄清的石灰水变混浊,能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C、D属于二氧化碳和二氧化硫;E为单质,D、E均能使品红溶液褪色,能使品红溶液褪色的有氯气和二氧化硫,所以D是二氧化硫,C是二氧化碳,E是氯气;I是一种红棕色固体氧化物,I是氧化铁;B、F为单质,其中F为黑色固体,F和B反应生成二氧化碳,所以F是碳,B是氧气;A和氧气反应生成二氧化碳和二氧化硫,所以A是;氯气和水、二氧化硫反应生成硫酸和盐酸,碳和硫酸反应,所以G是硫酸,H是盐酸;盐酸和氧化铁反应生成氯化铁和水,所以J是氯化铁;K为单质,J和K反应生成L,L和氯气反应生成氯化铁,所以L是氯化亚铁,K是铁.
(1)E是氯气,E的电子式为:
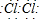
.
故答案为:
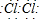
.
(2)氯气和二氧化硫、水反应生成硫酸和盐酸,离子反应方程式为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+.
故答案为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+
(3)碳和硫酸在加热条件下反应生成二氧化硫和二氧化碳、水,
反应方程式为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
(4)二价铁离子的检验方法是:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色就证明有二价铁离子存在.
故答案为:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色.
(5)气体A的密度为相同状况下氢气密度的30倍,所以A的相对分子量是氢气的30倍,即A的相对分子量为60,且A中含3种组成元素,通过以上分析A中一定含有硫和碳元素,且A和氧气反应后生成二氧化硫和二氧化碳,所以A含有氧元素,分子式为SCO;A分子中各原子均达8电子稳定结构,则其结构式为S=C=O.
故答案为:SCO;S=C=O.
本题解析:
本题难度:一般
2、填空题 (6分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,A为日常生活中常见的金属单质, G为黄绿色气体,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。

请回答下列问题:
(1)H的化学式为_______________。(2)反应②在工业上通常称之为__________工业。
(3)写出反应③的离子方程式?。
(4)写出反应②的化学方程式?。
参考答案:(6分)(1)NaOH? (2)氯碱工业
(3)Al2O3+2OH- =2AlO2-+H2O? 2NaCl+2H2O=2NaOH+H2+Cl2
本题解析:略
本题难度:一般
3、填空题 (10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的元素已经略去。
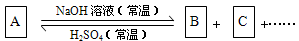
(1)若A与NaOH按不同物质的量比反应,既可只生成B,又可只生成C,还可生成B+C。
①写出符合上述反应关系的A的化学式?。
②写出上述有关反应的离子方程式:
生成B的离子方程式为?。
生成C的离子方程式为?。
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是
?(只写一种),该反应的离子方程式为?。
R在A、B、C中的化合价必须满足的条件是?。
参考答案:(10分)
CO2(或AlCl3);? CO2+2OH-=CO32-+H2O;? CO2+OH-=HCO3-;
Cl2+2OH-=Cl-+ClO-+H2O;? R在A中的化合价处于B、C中化合价之间;
本题解析:略
本题难度:简单
4、选择题 已知甲、乙、丙、丁四种无机物均由原子序数为前18号的元素组成,且它们之间的转化关系如下:
甲
乙丙丁,下列说法正确的是( )
A.甲一定为单质
B.丙一定为氧化物
C.丁一定为酸
D.甲、乙、丙、丁的相对分子质量一定是16或16的倍数
参考答案:B
本题解析:
本题难度:一般
5、简答题 下列各单质与化合物之间的关系如图,单质及化合物的组成元素皆为短周期元素.
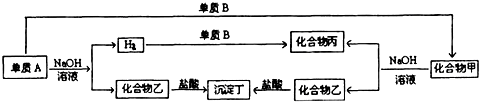
(1)若沉淀丁不溶于过量的盐酸,则单质A为______丁为______;
若沉淀丁溶于过量的盐酸,则单质A为______甲为______;
(2)①沉淀丁不溶于过量盐酸时,化合物乙与盐酸反应:______;
②沉淀丁溶于过量盐酸时,化合物乙与过量盐酸反应:______.
参考答案:(1)结合转化关系可知,若沉淀丁不溶于过量的盐酸,丁为H2SiO3,则A为Si;若沉淀丁溶于过量的盐酸,则由转化关系可知,丁为Al(OH)3,则A为Al,铝和B反应生成甲,甲能和氢氧化钠溶液反应,氧化铝能和氢氧化钠溶液反应,所以B是氧气,甲是Al2O3,
故答案为:Si;H2SiO3;Al;Al2O3;
(2)①沉淀丁不溶于过量盐酸时,化合物乙与盐酸反应为Na2SiO3+2HCl═H2SiO3↓+2NaCl,故答案为:Na2SiO3+2HCl═H2SiO3↓+2NaCl;
②沉淀丁溶于过量盐酸时,化合物乙与过量盐酸反应为NaAlO2+HCl+H2O═Al(0H)3↓+NaCl,故答案为:NaAlO2+HCl+H2O═Al(0H)3↓+NaCl.
本题解析:
本题难度:一般