1、选择题 图示化学变化的类型属于
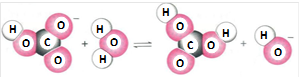
A.取代
B.水解
C.中和
D.电离
参考答案:B
本题解析:由图示可知阴离子结合水电离出的氢离子生成了弱电解质和氢氧根离子,符合水解反应的原理,故选:B.
本题难度:一般
2、选择题 在H2O+CH3COO-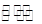 CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
A.加入NaOH固体
B.加入冰醋酸
C.增大压强
D.升高温度
参考答案:D
本题解析:加入AB使水解平衡逆向移动,C增大压强无影响;D升温促进水解平衡正向移动。
本题难度:一般
3、选择题 下列叙述不正确的是
A.常温下醋酸分子可能存在于pH>7的碱性溶液中
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.0.1mol·L-1的氯化铵溶液与0.05mol·L-1的氢氧化钠溶液等体积混合后,混合溶液中离子浓度:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)
D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
参考答案:D
本题解析:略
本题难度:简单
4、选择题 在10 mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是(?)
A.C(Na+)>C(Ac-)>C(H+)>C(OH-)
B.C(Na+)>C(Ac-)> C(OH-) > C(H+)
C.C(Na+)= C(Ac-)+ C(HAc)
D.C(Na+)+ C(H+)= C(Ac-)+ C(OH-)
参考答案:A
本题解析:根据电荷守恒定律可知,C(Na+)+ C(H+)= C(Ac-)+ C(OH-),所以选项A是错误的,其余都是正确的,答案选A。
本题难度:一般
5、填空题 (12分)在常温下,下列三种溶液:①0.1mol/L NH4Cl?②0.1mol/L CH3COONH4?③0.1mol/L NH4HSO4?
请根据要求填写下列空白:
(1)溶液①呈??性(填“酸”、“碱”或“中”),其原因是:
?(用离子方程式表示)
(2)在上述三种溶液中,pH最小的是?;c(NH4+)最小的是??﹝填序号﹞
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) ??c(NH4+)(填“>”、“<”或“=”)
参考答案:(12分)(每空2分)
(1)?酸? NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(2)?③?②
(3)? ="?" =
本题解析:略
本题难度:一般