1、选择题 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径,X元素为( )
A.Al
B.P
C.Ar
D.K
参考答案:D
本题解析:由题意可知,元素X形成的离子与钙离子的核外电子排布相同,则K、L、M电子层上的电子数分别为2、8、8,X的离子半径小于负二价硫离子的半径,对于电子层结构相同的离子,核电荷数越大,半径越小,所以X的核电荷数应大于S的核电荷数,符合要求的元素是K,故D项正确。
本题难度:一般
2、选择题 金属钛对人体体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关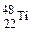 和
和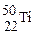 的说法中正确的是?
的说法中正确的是?
A. 和
和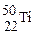 的质量数相同,互称为同位素
的质量数相同,互称为同位素
B. 和
和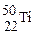 的质子数相同,互称同位素
的质子数相同,互称同位素
C. 和
和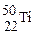 的质子数相同,是同一种核素
的质子数相同,是同一种核素
D. 与
与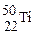 核外电子数相同,中子数不同,不能互称为同位素
核外电子数相同,中子数不同,不能互称为同位素
参考答案:
B
本题解析:
本题考查同位素。互为同位数的原子质子数相同,中子数和质量数都不同,所以A选项错误,B选项正确。核素即为一种原子, 和
和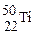 是两种不同的原子,C选项错误;核外电子数等于质子数,D选项错误。
是两种不同的原子,C选项错误;核外电子数等于质子数,D选项错误。
本题难度:一般
3、选择题 要从苯酚的乙醇溶液中回收苯酚,合理的操作顺序是
①蒸馏
②过滤
③静置分液
④加入足量Na
⑤通入足量CO2
⑥加入足量NaOH溶液
⑦加入乙酸和浓H2SO4的混合液后加热
⑧加入足量的FeCl3溶液.
A.④⑤③
B.⑦①
C.⑧②⑤③
D.⑥①⑤③
参考答案:D
本题解析:分析:乙醇不与氢氧化钠溶液反应,苯酚和氢氧化钠溶液反应,全部变成苯酚钠.这样原来的溶液就变成了苯酚钠、氢氧化钠溶液(加入氢氧化钠溶液是过量的)中混有乙醇.根据乙醇和水的沸点不同,加热蒸馏乙醇被全部蒸馏掉,而剩下的苯酚钠、苛性钠溶液不变.最后通入过量的二氧化碳气体,氢氧化钠全部转化为苯酚.苯酚不溶水,与生成的NaHCO3溶液分层,静置后分液可以得到苯酚.
解答:根据乙醇不与氢氧化钠溶液反应,加入氢氧化钠溶液后,苯酚的乙醇溶液中,乙醇不会发生任何变化,但苯酚全部变成苯酚钠.这样原来的溶液就变成了苯酚钠、氢氧化钠溶液(加入氢氧化钠溶液是过量的)中混有乙醇.乙醇的沸点是78度,水的沸点是100度.这样加热到78度,达到乙醇的沸点,乙醇被全部蒸馏掉,而剩下的苯酚钠、氢氧化钠溶液不变.最后通入过量的二氧化碳气体,由于碳酸酸性强于苯酚酸性,所以加入二氧化碳后,氢氧化钠先全部转化为NaHCO3(加入过量二氧化碳),然后苯酚钠全部转化为苯酚.苯酚不溶水,与生成的NaHCO3溶液分层,静置后分液可以得到苯酚,
即正确的操作为⑥加入足量NaOH溶液、①蒸馏、⑤通入足量CO2、③静置分液,
故选D.
点评:本题考查混合物的分离,注意苯酚和乙醇的性质差异是解答的关键,题目难度不大,熟悉蒸馏、分液即可解答.
本题难度:一般
4、选择题 下列关于元素周期表的说法正确的是(?)
A.元素周期表共有七个周期
B.元素周期表共有18个族
C.所含元素种数最多的族是VIII族
D.第三周期元素的原子核外都有三个电子层
参考答案:AD
本题解析:略
本题难度:简单
5、选择题 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
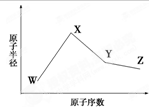
A.对应简单离子半径X<W
B.对应气态氢化物的稳定性Y<Z
C.化合物XZW既含离子键也含共价键
D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
参考答案:D
本题解析:A. W的质子数为18-10=8,所以W为O元素;由于在同一周期的元素,原子序数越大,原子半径就越小。而不同周期的元素,原子核外的电子层数越多,原子半径越大。X原子序数与Ne相差1,结合原子半径可知X为Na元素;Y的单质是一种常见的半导体材料;则Y为Si元素;Z原子序数大于Si,而且其非金属性在同周期元素中最强,那么Z为Cl元素。A. Na+、O2-电子层结构相同。对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小。所以 对应简单离子半径Na+< O2-。正确。B.元素的非金属性越强,对应气态氢化物就越稳定。非金属性Si<Cl,所以稳定性SiH4 <HCl。正确。C.化合物NaClO是离子化合物,既含离子键也含共价键。正确。D. SiO2是酸性氧化物,只能与强碱NaOH发生反应:SiO2+2NaOH=Na2SiO3+H2O,而不能与HClO4发生反应。错误。
本题难度:一般