1、填空题 在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 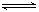 ?2NH3(g)? ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
?2NH3(g)? ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
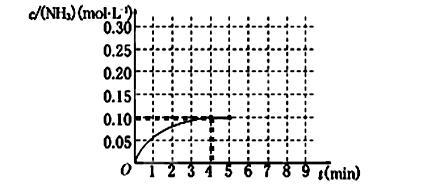
(1)根据上图,计算从反应开始到平衡时,氢气的平均反应速率v(H2)为______________。
(2)该反应达到平衡时N2的转化率_________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________。(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1? d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式_________,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1?K2(填“>”、“="”" 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
参考答案:
(1)0.0375 mol·L-1·min-1
(2)50%
(3)a、c
(4)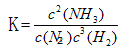 ? >
? >
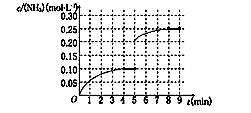
(5)
本题解析:(1)v(H2)="3/2" v(NH3)=3/2×0.10mol/L÷4min=0.0375 mol·L-1·min-1。
N2(g)+3H2(g) 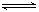 ?2NH3(g)
?2NH3(g)
初始浓度(mol?L?1)0.1? 0.3? 0
初始浓度(mol?L?1)0.05? 0.15? 0.1
初始浓度(mol?L?1)0.05? 0.15? 0.1
则该反应达到平衡时N2的转化率=0.05mol?L?1÷0.1mol?L?1×100%=50%
(3)根据化学方程式可知NH3的浓度范围0<c(NH3)<0.2mol?L?1,原平衡NH3的浓度为0.10mol?L?1,温度改变,平衡移动会发生移动,新平衡的浓度一定不是0.10mol?L?1,故a、c项不可能。
(4)根据平衡常数的定义可得该反应的平衡常数表达式为: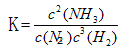 ;因为正反应为放热反应,温度升高,平衡向逆反应方向移动,平衡常数减小,所以K1>K2。
;因为正反应为放热反应,温度升高,平衡向逆反应方向移动,平衡常数减小,所以K1>K2。
(5)第5分钟末将容器的体积缩小一半后,NH3的浓度变为0.20mol?L?1,压强增大,平衡向右移动,NH3的浓度逐渐增加,到8min末为0.25mol?L?1,即可画出曲线。
本题难度:一般
2、选择题 在某固定容积的密闭容器中充入1molA,一定条件下建立如下化学平衡:
aA(g) bB(g)+cC(g),在温度不变的条件下,再充入一定量的A物质。下列说法正确的是 ( )
A.在建立新平衡的过程中,A分解的速率与B消耗的速率之比为a:b
B.在建立新平衡的过程中,混合气体的密度逐渐减小
C.重新达平衡时,A的转化率一定增大
D.若a=b+c,重新达平衡时,B的体积分数不变