1、选择题 下列相关说法中正确的是( )
A.1.0?mol?L-1的KNO3溶液中能大量存在:H+、Fe2+、Cl-、SO42-
B.一定条件下,足量铜与200g?98%的浓硫酸充分反应,转移电子数目为2NA
C.向淀粉碘化钾溶液滴几滴稀硫酸后溶液变为蓝色,反应的离子方程式为:4I-+O2+2H2O=2I2+4OH-
D.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3:2
参考答案:A.H+、Fe2+、NO3-发生氧化还原反应,则不能大量共存,故A错误;
B.一定条件下,足量铜与200g?98%的浓硫酸充分反应,随反应的进行,浓硫酸变为稀硫酸,反应不能继续进行,转移电子数目小于2NA,故B错误;
C.向淀粉碘化钾溶液滴几滴稀硫酸后溶液变为蓝色,反应的离子方程式为4H++4I-+O2=2I2+2H2O,故C错误;
D.Cr元素的化合价降低,I元素的化合价升高,则氧化产物为I2,还原产物为Cr3+,由电子守恒可知,氧化产物与还原产物的物质的量之比为3:2,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A.2F2+2H2O=4HF+O2↑
B.2Na+2H2O=2NaOH+H2↑
C.C12+H2O=HC1O+HC1
D.C+H2O?
CO+H2
参考答案:A.该反应中,水中氧元素的化合价都升高,所以反应是氧化还原反应,水做还原剂,故A不选;
B.该反应中,水中氢元素化合价降低,所以水是氧化剂,故B不选;
C.该反应中,氯气中的氯元素有的化合价升高有的降低,所以该反应是氧化还原反应,水中的各元素化合价都不发生变化,所以水既不是氧化剂又不是还原剂,故C选;
D.该反应中,水中的氢元素化合价降低,所以水是氧化剂,故D不选;
故选C.
本题解析:
本题难度:一般
3、选择题 周杰伦在歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中的“铜绿”即是铜锈,它的化学成分是Cu2(OH)2CO3(碱式碳酸铜).铜在潮湿的空气中生锈的化学反应为:2Cu+O2+CO2+H2O═Cu2(OH)2CO3.下列有关该反应的说法正确的是( )
A.该反应不是氧化还原反应
B.该反应中氧元素和碳元素化合价发生变化,所以是氧化还原反应
C.该反应中铜得电子,O2失电子,所以是氧化还原反应
D.该反应是氧化还原反应,变价的只有两种元素
参考答案:2Cu+O2+CO2+H2O═Cu2(OH)2CO3中,Cu元素的化合价升高,氧气中O元素的化合价降低,
A.该反应属于氧化还原反应,故A错误;
B.该反应中氧元素和铜元素化合价发生变化,所以是氧化还原反应,而C元素的化合价不变,故B错误;
C.该反应中铜失去电子,O2得到电子,所以是氧化还原反应,故C错误;
D.该反应是氧化还原反应,变价的只有Cu、O两种元素,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 如图中,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
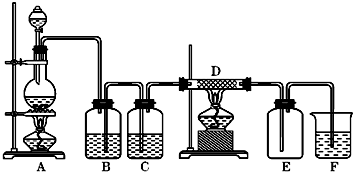
(1)上述装置中有一处错误,请指出是______处(用字母表示).
(2)通过B是为了除去______,在B中应加入______;通过C是为了除去______.
(3)写出D、F中发生反应的化学方程式______、______.
(4)如果A中产生氯气3.36L(标准状况),请计算:
①写出A中方程式,并用双线桥法分析A中的电子转移情况______.
②消耗MnO2的物质的量______.
③被氧化的HCl的物质的量______.
参考答案:(1)B装置是除去氯气中含杂质气体氯化氢,装置中导管短进长出,洗气装置除杂质要遵循长进短出,所以B装置错误;故答案为:B;
(2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,所以可用饱和食盐水除去氯气中混有的氯化氢气体;水蒸气和铁在高温的条件下反应干扰实验,利用浓硫酸的吸水性,且不和氯气反应,用浓硫酸干燥氯气,
故答案为:HCl;饱和食盐水;水蒸气;
(3)氯气有强氧化性,能把变价金属氧化成最高价态,所以氯气和铁反应的生成物是氯化铁;氯气有毒,污染环境,所以不能排空,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠、水,所以可用氢氧化钠吸收多余的氯气,
故答案为:2Fe+3Cl2?点燃?.?2FeCl3 ;Cl2+2NaOH=NaCl+NaClO+H2O;
(4)①氧化还原反应根据氧化剂和还原剂可以分为:完全氧化还原反应和部分氧化还原反应,这是一个部分氧化还原反应,化合价降低元素是Mn元素,二氧化锰为氧化剂,化合价升高元素是Cl元素,HCl是还原剂,但氯化氢部分(50%)被氧化,故答案为:
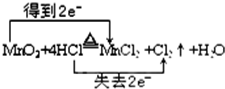
;
②由反应MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O系数比得:n(MnO2)=n(Cl2)=3.36L22.4L/mol=0.15mol,
故答案为:0.15mol;?
③由反应MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O系数比得:被氧化的HCl的物质的量n(HCl)=2n(Cl2)=2×0.15mol=0.3mol,
故答案为:0.3mol.
本题解析:
本题难度:一般
5、填空题 分析下列反应中水的作用.
A.2H2O?
2H2↑+O2↑? ?B.2F2+2H2O=4HF+O2 C.Cl2+H2O=HCl+HClO?D.2Na+2H2O=2NaOH+H2↑
试用相应的反应代号(A、B、C、D)回答下列问题:
H2O只作氧化剂的是______;H2O只作还原剂的是______;H2O既作氧化剂又作还原剂的是______;H2O既不作氧化剂又不作还原剂的是______.
参考答案:A.水中H元素的化合价降低,O元素的化合价升高,则属于氧化还原反应,且水既作氧化剂又作还原剂;
B.反应中F元素的化合价降低,O元素的化合价升高,则属于氧化还原反应,水作还原剂;
C.氯气中Cl元素的化合价既升高又降低,则属于氧化还原反应,但水中H、O元素的化合价均不变,则水在氧化还原反应中既不作氧化剂又不作还原剂;
D.反应中Na元素的化合价升高,水中H元素的化合价降低,则属于氧化还原反应,水作氧化剂;
故答案为:D,B,A,C.
本题解析:
本题难度:一般