1、填空题 标出下列反应中电子转移的方向和数目并回答问题:3H2O2+2H2CrO4=2Cr(OH)3+3O2+2H2O
(1)该反应中的还原剂是______,被还原的元素______,还原产物是______;
(2)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为______.
参考答案:Cr化合价从+6→+3,得电子,0化合价从-1→0,失电子,因此箭头指向由O指向Cr,电子总数为:2×(6-3)=6,用单线桥法表示反应中电子转移的方向和数目如下: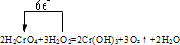 ,
,
(1)该反应中失电子化合价升高的反应物是H2O2,得电子化合价降低的元素是H2CrO4中的Cr或+6价的Cr,所以被还原的元素是Cr6+,则H2CrO4是氧化剂发生还原反应,还原产物是Cr(OH)3,
故答案为:H2O2;H2CrO4中的Cr或+6价的Cr;H2CrO4,Cr(OH)3;
(2)根据得失电子守恒得生成氧气的物质的量为0.3mol2═0.15mol,标况下氧气的体积为:0.15mol×22.4L/mol=3.36L,故产生的氧气体积为3.36L,
故答案为:3.36L.
本题解析:
本题难度:简单
2、填空题 工业上制备的高锰酸钾是锰的重要化合物和常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
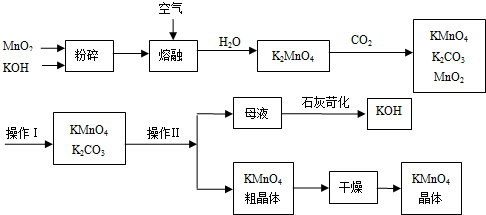
①KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是______(填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______(填代号).
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
③上述流程中可以循环使用的物质有、(写化学式)______.
④若不考虑物质循环与制备过程中的损失,则1molMnO2______可制得molKMnO4.
⑤该生产中需要纯净的CO2气体.若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)______.
a.石灰石 b.稀HCl c.稀H2SO4 d.纯碱.
参考答案:①高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒.
a、次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故正确;
b、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故正确;
c、苯酚是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;
d、酒精是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;
故选ab;
②见光易分解的物质常常保存在棕色试剂瓶中.
a.浓硝酸见光分解生成二氧化氮、氧气和水,所以要保存在棕色试剂瓶中,故不选;
b.硝酸银见光分解生成银、二氧化氮和氧气,所以要保存在棕色试剂瓶中,故不选;
?c.氯水中的次氯酸见光分解生成盐酸和氧气,所以要保存在棕色试剂瓶中,故不选;
d.烧碱见光不分解,所以不要保存在棕色试剂瓶中,故选;
故选d;
③在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用,故答案为:MnO2、KOH;
④根据锰元素守恒知,1molMnO2生成1molK2MnO4,锰酸钾和二氧化碳反应的方程式为 3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,根据方程式知,1molK2MnO4和二氧化碳反应生成23molKMnO4,
故答案为:23;
⑤石灰石和酸反应是放热反应,盐酸具有挥发性,所以制取的二氧化碳中含有氯化氢导致气体不纯,则不能选用盐酸和石灰石;
稀硫酸和碳酸钙反应生成微溶的硫酸钙阻止进一步的反应,则不能选用石灰石和硫酸;
而稀硫酸和纯碱反应生成二氧化碳,稀硫酸没有挥发性,硫酸钠是可溶性的物质,所以可以制取较纯净的二氧化碳,则选用稀硫酸和纯碱;
故选cd.
本题解析:
本题难度:一般
3、选择题 下列反应中,化合物不作氧化剂的是( )
A.用锌和稀硫酸反应制取氢气
B.用氢气和灼热的氧化铜反应制取铜
C.用氯气和石灰乳反应制取漂白粉
D.用碳和高温水蒸气反应制取氢气
参考答案:A.锌和稀硫酸反应生成硫酸锌和氢气,锌被氧化,硫酸被还原,硫酸为氧化剂,故A不选;
B.用氢气和灼热的氧化铜反应制取铜,氧化铜为氧化剂,氢气为还原剂,故B不选;
C.氯气和石灰乳反应,氯气自身发生氧化还原反应,石灰乳既不是氧化剂也不是还原剂,故C选;
D.碳和高温水蒸气反应制取氢气,水被还原生成氢气,水为氧化剂,故D不选.
故选C.
本题解析:
本题难度:一般
4、填空题 A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属.D可分别跟A、B、C在一定的条件下化合,生成X、Y、Z;Y、Z与Ne的电子数相等,A是第三周期的元素.有关的转化关系如下图所示(反应条件均已略去):
(1)A的化学式为______,B的化学式为______,C的电子式为______.
(2)Z和W在催化剂和加热的条件下反应生成C和Y,这是一个很有意义的反应,可以消除W对环境的污染,该反应的化学方程式为______.
(3)将N溶液滴入G的溶液中会产生W,写出上述变化的离子反应方程式:______.
(4)Z与N恰好反应后产物溶解在水中,所得溶液的pH(填“大于”、“小于”或“等于”)______7,用离子反应方程式表示其原因为______.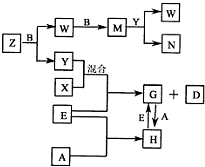
参考答案:A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气体.E是地壳中含量居第二位的金属,则E为铁;Y、Z与Ne的电子数相等,则Y、Z为10电子微粒,再由框图中G与H的转化可知,A是第三周期的元素,A在常温下为气体,则A为氯气,H为氯化铁,G为氯化亚铁;再由转化中X与Y混合与铁反应,则D为氢气,X为氯化氢,Y为水,即B为氧气;由Z和B→W,W和B→M,M和Y反应生成W和N,则Z为氨气,即C为氮气,W为NO,M为NO2,N为硝酸;
(1)因A为氯气,其化学式为Cl2,B为氧气,其化学式为O2,C为氮气,其电子式为
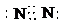
,故答案为:Cl2;O2;
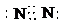
;
(2)Z和W在催化剂和加热的条件下反应生成C和Y,即氨气和NO反应生成氮气和水,其反应为6NO+4NH3

5N2+6H2O,
故答案为:6NO+4NH3

5N2+6H2O;
(3)将N溶液滴入G的溶液中会产生W,即硝酸滴到氯化亚铁溶液中发生氧化还原反应生成NO,离子反应为4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+,
故答案为:4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+;
(4)Z与N恰好反应后产物溶解在水中所得溶液为硝酸铵溶液,由铵根离子的水解反应NH4++H2O

NH3?H2O+H+可知该溶液显酸性,溶液的pH小于7,
故答案为:小于;NH4++H2O

NH3?H2O+H+.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.酸性氧化物就是非金属氧化物
B.纯净物与混合物的区别是看是否只含有一种元素
C.强弱电解质的区别是溶液的导电能力的大小
D.氧化还原反应的判断依据是反应过程中元素的化合价是否发生变化
参考答案:A、金属氧化物也可以是酸性氧化物,如Mn2O7是酸性氧化物,故A错误;
B、纯净物与混合物的区别是看组成的物质种类;只含有一种元素的物质不一定是纯净物;如氧气和臭氧形成的混合物,故B错误;
C、强弱电解质的区别是在溶液中的电离程度判断,溶液导电能力与离子浓度有关;水溶液中全部电离的电解质为强电解质,部分电离的电解质为弱电解质,故C错误;
D、化合价的变化是氧化还原反应的特征;所以氧化还原反应的判断依据是反应过程中元素的化合价是否发生变化,故D正确;
故选D.
本题解析:
本题难度:一般