1、选择题 下列离子方程式书写正确的是
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O=2Fe2++ +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2 +Ca2++2OH-=CaCO3↓+2H2O+
+Ca2++2OH-=CaCO3↓+2H2O+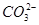
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2 +2Ba2++4OH-=2BaSO4↓+
+2Ba2++4OH-=2BaSO4↓+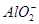 +2H2O
+2H2O
参考答案:D
本题解析:A项,应是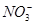 (H+)氧化SO2;B项,由于n(FeI2)∶n(Cl2)=4∶5,I->Fe2+,离子方程式为2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-;C项,应为
(H+)氧化SO2;B项,由于n(FeI2)∶n(Cl2)=4∶5,I->Fe2+,离子方程式为2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-;C项,应为 +OH-+Ca2+=CaCO3↓+H2O;D项正确。
+OH-+Ca2+=CaCO3↓+H2O;D项正确。
本题难度:一般
2、选择题 下列电离方程式书写完全正确的是( )
A.H2SO4═H++SO42-
B.Ca?(OH)2═Ca2++(OH)22-
C.NaCl═Na++Cl-
D.Al2(SO4)3═Al23++3SO42-
参考答案:A.H2SO4为强电解质,电离方程式为H2SO4═2H++SO42-,故A错误;
B.Ca?(OH)2为强电解质,电离方程式为Ca?(OH)2═Ca2++2OH-,故B错误;
C.NaCl为强电解质,电离方程式为NaCl═Na++Cl-,故C正确;
D.Al2(SO4)3为强电解质,电离方程式为Al2(SO4)3═2Al3++3SO42-,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 (1)根据下列几种粒子的结构示意图,回答问题:
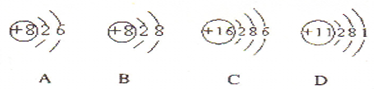
①其中属于阴离子的是______,属于金属元素的是______.(填编号)
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式______.______
(2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有______种.
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
①在该反应中,氧化剂是______,还原剂是______.
②当有0.20mol电子发生转移时,生成氯气的体积为______L(标准状况)
参考答案:(1)①阴离子是质子数小于核外电子数.故B表示阴离子;金属元素原子最外层电子数少于4,故D表示金属元素,故答案为:B;D;
②A、C、D的核内质子数分别为8、16、11,所以三种元素为O、S、Na,形成的化合物为Na2SO4或Na2SO3,均为可溶性的钠盐,是强电解质,电离方程式为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-),故答案为:Na2SO4═2Na++SO42- (或Na2SO3═2Na++SO32-);
(2)由氧的同位素有16O、17O、18O,氢的同位素有11H、12H、13H,在1个水分子中含有2个氢原子和1个氧原子,
若水分子中的氢原子相同,
则16O可分别与11H、12H、13H构成水,即存在三种水;
17O可分别与11H、12H、13H构成水,即存在三种水;
18O可分别与11H、12H、13H构成水,即存在三种水;
若水分子中的氢原子不同,
则16O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
17O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
18O可分别与11H12H、12H13H、11H13H构成水,即存在三种水;
?所以共形成3×6=18种水,故答案为:18;
(3)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,通过化合价升降判断,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,高锰酸钾得电子是氧化剂,HCl失电子是还原剂,故答案为:KMnO4;HCl;
(2)设反应中有0.20mol电子发生转移,生成氯气的体积为x,
? 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O? 转移电子10e-,
? 所以电子与氯气的关系式为10e-~5Cl2
? ?10mol? 5×22.4L?
? 0.20mol? x
? x=2.24L,
? 所以生成气体是2.24L,故答案为:2.24L.
本题解析:
本题难度:简单
4、选择题 下列化学过程及其表述正确的是?(?)
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3 mol·L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
参考答案:C
本题解析:
本题考查的是有隐含条件的离子共存及与量有关的离子方程式书写。A.要使得溶液显中性,那么
H+与OH-的量必须1:1。1molNaHSO4电离出1molH+,1molBa(OH)2电离出2molOH-,所以n(NaHSO4):n[Ba(OH)2]=2:1。所以离子方程式应为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O。B.由水电离的c(H+)为10-3 mol·L-1,说明该溶液是促进了水的电离。水中c(H+)=10-7mol·L-1,所以该溶液中必含有弱碱阳离子(Fe3+、Cu2+ 、Al3+等)或弱酸根离子(CO32-,CH3COO-等),如果溶液中存在Fe3+,Cu2+的话,那么显然与SO32-不能大量共存。D.KMnO4溶液不能用浓盐酸酸化,酸性条件下KMnO4溶液会与浓盐酸发生反应,也不能用浓HNO3酸化(因浓HNO3本身具有强氧化性)。C.Al3++2SO42-+ 2Ba2++4OH-= 2BaSO4↓+AlO2-+2H2O,沉淀总物质的量为2mol,质量为466g。Al3++ SO42-+
SO42-+ Ba2++3OH-=
Ba2++3OH-= BaSO4↓+Al(OH)3↓,这种情况下,沉淀总物质的量为2.5mol,总质量为427.5g。所以C正确。
BaSO4↓+Al(OH)3↓,这种情况下,沉淀总物质的量为2.5mol,总质量为427.5g。所以C正确。
本题难度:简单
5、选择题 能正确表示下列反应的离子方程式为( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3—+Ba2++OH-===BaCO3↓+H2O
C.少量CO2通入硅酸钠溶液中:SiO32—+2CO2+2H2O===H2SiO3↓+2HCO3—
D.硫化钠水溶液呈碱性:S2-+2H2O H2S+2OH-
H2S+2OH-
参考答案:B
本题解析:A、硫化亚铁溶于稀硝酸中时,因硝酸具有强氧化性,可以将亚铁离子氧化为三价,也会将硫化氢氧化,所以产物中不会生成Fe2+和H2S,故A错误。
B、含等物质的量的KHCO3和Ba(OH)2溶液混合,钡离子和碳酸氢根按物质的量之比1:1反应,即HCO3—+Ba2++OH-=BaCO3↓+H2O,故B正确。
C、少量CO2通入硅酸钠溶液中:SiO32—+CO2+H2O===H2SiO3↓+CO32-,故C错误。
D、硫化钠中的硫离子是多元弱酸根离子,分步水解,以第一步为主,为:S2-+H2O=HS-↑+OH-,故D错误
点评:本题考查学生离子方程式的书写的正误判断知识,注意物质用量的多少所决定的反应产物的情况,综合性较强,难度较大。
本题难度:一般