1、选择题 下列离子方程式书写正确的是
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O=2Fe2++ +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2 +Ca2++2OH-=CaCO3↓+2H2O+
+Ca2++2OH-=CaCO3↓+2H2O+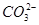
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2 +2Ba2++4OH-=2BaSO4↓+
+2Ba2++4OH-=2BaSO4↓+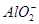 +2H2O
+2H2O
2、选择题 下列电离方程式书写完全正确的是( )
A.H2SO4═H++SO42-
B.Ca?(OH)2═Ca2++(OH)22-
C.NaCl═Na++Cl-
D.Al2(SO4)3═Al23++3SO42-
3、填空题 (1)根据下列几种粒子的结构示意图,回答问题:
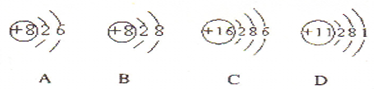
①其中属于阴离子的是______,属于金属元素的是______.(填编号)
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式______.______
(2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有______种.
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
①在该反应中,氧化剂是______,还原剂是______.
②当有0.20mol电子发生转移时,生成氯气的体积为______L(标准状况)
4、选择题 下列化学过程及其表述正确的是?(?)
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.由水电离的c(H+)为10-3 mol·L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存
C.向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
5、选择题 能正确表示下列反应的离子方程式为( )
A.硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B.含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3—+Ba2++OH-===BaCO3↓+H2O
C.少量CO2通入硅酸钠溶液中:SiO32—+2CO2+2H2O===H2SiO3↓+2HCO3—
D.硫化钠水溶液呈碱性:S2-+2H2O H2S+2OH-
H2S+2OH-