1、选择题 氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠(NaClO3)的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O
参考答案:
本题解析:
本题难度:一般
2、选择题 现有E、F、G、M、N五种可溶的强电解质,它们在水中电离产生下列离子(各种离子不重复)。
A.N溶液与过量的F溶液反应的离子方程式: Ba2++SO42-=BaSO4↓
B.E溶液与N溶液混合发生反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
C.M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中
D.将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-=CO2↑+H2O
参考答案:B
本题解析:试题分析:根据题意推导可知:E为Na2CO3,N为Al2SO4,F为Ba(OH)2,G为H2SO4,M为AgNO3。A、还有AlO2-生成,错误;B、正确;C、二者溶液混合生成AgOH能溶于氨水,错误;D、等体积等浓度混合生成HCO3-,错误。
考点:考查了离子方程式的书写。
本题难度:一般
3、选择题 250℃和1.01×105 Pa时,反应2N2O5(g)= 4NO2(g)+O2(g)? ΔH=+56.76kJ/mol,自发进行的原因是
A.是吸热反应
B.是放热反应
C.熵增效应大于能量效应
D.是熵减反应
参考答案:C
本题解析:试题分析:反应能自发进行,应有△G=△H-T·△S<0,因△H>0,则△H<T·△S,说明取决于焓变和熵变的综合判据。选C
考点:反应热和焓变
本题难度:一般
4、选择题 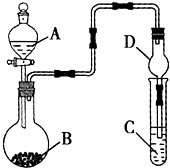 利用如图所示的装置进行实验,将液体A逐滴加入烧瓶中与B发生反应,下列有关叙述中不正确的是
利用如图所示的装置进行实验,将液体A逐滴加入烧瓶中与B发生反应,下列有关叙述中不正确的是
A.若A为硫酸,B为亚硫酸钠,C中盛品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛AgCl3溶液,则C中先产生沉淀后沉淀溶解
D.仪器D可以起到防止溶液倒吸的作用
参考答案:C
本题解析:分析:A、亚硫酸钠和硫酸反应生成二氧化硫气体,二氧化硫具有漂白作用;
B、醋酸和贝壳中碳酸钙反应生成二氧化碳气体,通入澄清石灰水变浑浊;
C、浓氨水滴入氧化钙放热使一水合氨分解生成氨气,通入氯化铝溶液中生成白色沉淀,氢氧化铝不溶于氨水;
D、D装置上部容积较大,倒吸的液体靠自身重量回落;
解答:A、亚硫酸钠和硫酸反应生成二氧化硫气体,二氧化硫具有漂白作用,通入C中品红溶液,则C中溶液褪色,故A正确;
B、醋酸和贝壳中碳酸钙反应生成二氧化碳气体,二氧化碳通入澄清石灰水变浑浊,故B正确;
C、装置中 浓氨水滴入生石灰溶解放热生成氨气,氨气通入氯化铝溶液反应生成白色沉淀,氢氧化铝不溶于弱碱中,故C错误;
D、装置中较粗的部分可以防止液体倒吸,故D正确;
故选C.
点评:本题考查气体发生装置的分析判断,气体性质的熟练掌握是解题关键,题目难度中等.
本题难度:困难
5、填空题 工业上利用电解饱和食盐水可制得重要化工产品。
(1)写出化学方程式并标出电子转移的方向和数目:
(2)氧化剂:
还原剂:
(3)每转移1mol电子,可得到 mol氯气;
利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t。
参考答案:(1)
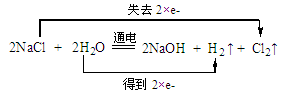
(2)H2O NaCl (3)0.5 58.5
本题解析:(1)电解饱和食盐水生成氢气、氯气和氢氧化钠,是氯碱工业的基础,反应中氯失去电子被氧化,氢得电子被还原;(2)化合价降低了的反应物为氧化剂,化合价升高了的反应物为还原剂;(3)每转移1mol电子,可得到0.5mol氯气;NaCl---HCl ,盐酸的物质的量为100t×36.5%÷36.5×58.5=58.5t 。
考点:电解饱和食盐水、氧化还原反应
本题难度:一般