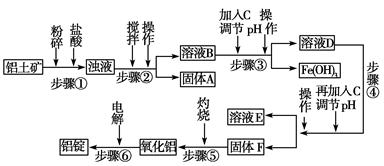
1、填空题 日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。
一些氢氧化物沉淀的pH如下表。
沉淀物
| Al(OH)3
| Fe(OH)3
| Mg(OH)2
|
开始沉淀pH(离子初始浓度0.01 mol/L)
| 4
| 2.3
| 10.4
|
完全沉淀pH(离子浓度<10-5mol/L)
| 5.2
| 4.1
| 12.4
|
?
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
参考答案:(1)过滤
(2)SiO2 NaOH溶液(其他合理答案也可)
(3)5.2<pH<10.4
(4)2Al2O3(熔融)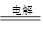 ?4 Al+3O2↑
?4 Al+3O2↑
本题解析:本题以工业生产铝锭的工艺流程为背景,考查内容包括pH的选择、过滤操作、常见金属元素及其化合物的主要性质等。SiO2是酸性氧化物不与盐酸反应,进行过滤操作(步骤②),得到固体A是SiO2;加入NaOH溶液,调节pH使Fe3+沉淀,步骤④是过滤得到氢氧化铝沉淀。步骤④为使Al3+完全沉淀,而Mg2+不能产生沉淀,需调节溶液的pH在5.2~10.4之间。
本题难度:一般
2、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58 g白色难溶物析出,向所得溶液中逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如右图所示:
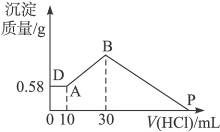
(1)混合物中NaOH的质量是___________g,AlCl3的质量是___________g,MgCl2的质量为___________g。
(2)P点表示盐酸加入的体积为___________mL。
参考答案:(1)2.6? 1.335? 0.95?(2)130
本题解析:(1)由图可知,三种物质混合时有0.58 g沉淀,当向此混合物中加入10 mL盐酸时,沉淀质量不变,说明混合物中NaOH过量,该沉淀是Mg(OH)2,由镁元素守恒可知:n(MgCl2)=n〔Mg(OH)2〕=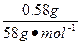 ="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
2NaOH?—? MgCl2—Mg(OH)2
0.02 mol? 0.01 mol
AlCl3?—? NaAlO2—HCl
0.01 mol?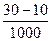 ×0.5 mol·L-1="0.01?" mol
×0.5 mol·L-1="0.01?" mol
m(AlCl3)="0.01" mol×133.5 g·mol-1="1.335" g
由图可知,B点是沉淀量最大点,此时溶液中溶质只有NaCl,由元素守恒可知:
n(NaOH)=n(HCl)+2n(MgCl2)+3n(AlCl3)="0.5" mol·L-1×0.03 L+2×0.01 mol+3×0.01 mol="0.065" mol,所以,m(NaOH)="0.065" mol×40 g·mol-1="2.6" g。
(2)由图可知,P点时Al(OH)3、Mg(OH)2沉淀恰好全部溶解在盐酸中,溶质为NaCl、AlCl3、MgCl2,所以,此时溶解Al(OH)3、Mg(OH)2沉淀恰好消耗盐酸:
V(HCl)=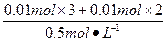 ="0.1" L="100" mL。
="0.1" L="100" mL。
由此可知,P点时,V(HCl)="30" mL+100 mL="130" mL。
本题难度:简单
3、选择题 下列选项中的哪种物质可以与氧化铁在高温下发生铝热反应
A.焦炭
B.一氧化碳
C.氧化铝
D.金属铝粉
参考答案:D
本题解析:略
本题难度:简单
4、选择题 下列物质中,既能跟稀硫酸反应,又能跟NaOH溶液反应的是(?)
①Al2O3;②Mg(OH)2;③Al(OH)3;④(NH4)2CO3;⑤NaHCO3;⑥AlCl3
A.①③⑤⑥
B.只有①③
C.只有②③
D.①③④⑤
参考答案:D
本题解析:氢氧化镁只能和酸反应,氯化铝只能和碱反应,其余选项都是既能跟稀硫酸反应,又能跟NaOH溶液反应的,答案选D。
点评:既能跟盐酸反应又能跟NaOH溶液反应物质有Al、氧化铝、氢氧化铝、弱酸的酸式盐、弱酸的铵盐等。另外还需要注意的是看清楚题意,即问的化合物还是单质,即必须按要求答题。
本题难度:一般
5、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
[? ]
A.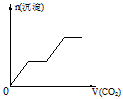
B.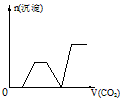
C.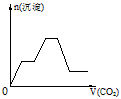
D.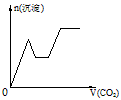
参考答案:C
本题解析:
本题难度:一般