1、选择题 氮化钠和氢化钠都是离子化合物,有关它们的叙述其中正确的是
①原子半径:rNa>rN>rH? ②离子半径:rNa+>rN3->rH+
③与水反应都是氧化一还原反应? ④水溶液都显碱性
⑤与盐酸反应都只生成NaCl
⑥氢化钠晶体结构与氯化钠晶体相同,与钠离子距离最近的钠离子共有12个
A.全都正确
B.①④⑥
C.①④⑤
D.②③⑤
参考答案:B
本题解析:同周期自左向右盈原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则①正确;核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,②不正确,离子半径应该是rN3->rNa+> rH+;氮化钠和氢化钠和水反应分别是氨气、氢氧化钠和氢气和氢氧化钠,前者是非氧化还原反应,后者是氧化还原反应,③不正确,④正确;⑤不正确,氮化钠还生成氯化铵;根据氯化钠的晶胞结构可知,选项⑥正确,答案选B。
点评:该题是高考中的常见题型,试题难度较大,对学生的思维能力提出了更高的要求。该题侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和抽象思维能力,提高学生的灵活应变能力。
本题难度:简单
2、选择题 X元素的阴离子,Y元素的阴离子和Z元素的阳离子具有相同的电子层结构,已知X的原子序数比Y的大,则X、Y、Z的三种离子半径的大小顺序是(分别用r1、r2、r3表示)(?)
A.r1 > r2 > r3
B.r2> r1> r3
C.r3 > r1 > r2
D.r3 > r2 > r1
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列有关族的叙述正确的是?(?)
A.IA族全是金属元素
B.所有主族元素的最高正价均等于其最外层电子数
C.元素周期表中第IIA族与第IIIA族位置相邻
D.元素周期表中有7个主族,7个副族,一个0族,一个Ⅷ族
参考答案:D
本题解析:氢位于第IA,是非金属,A不正确。氟是最强的非金属,没有正价,B不正确。从第四周期开始中间出现副族和第Ⅷ,C不正确。正确第答案是D。
本题难度:一般
4、填空题 (10分)下表是元素周期表中的一部分。
族
周?期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| E
| F
| ?
| H
| J
|
3
| B
| C
| D
| ?
| ?
| G
| I
| ?
|
根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是?,氧化性最强的单质是?。
(2)最高价氧化物对应的水化物中,碱性最强的是?,酸性最强的是?,呈两性的是?。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是?。
(4)在B、C、D、G、I中,原子半径最大的是?。
(5) 元素C与I形成的化合物的电子式的形成过程是:?。
参考答案:(1)Ne? F2?(各1分,共2分)
(2) NaOH? HClO4? Al(OH)3(各1分,共3分)
(3)HF(1分)?(4)Na(1分)?
(5)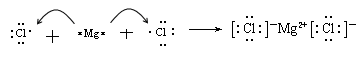 (2分)
(2分)
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,A—J分别是H、Na、Mg、Al、C、N、S、F、Cl、Ar。
(1)稀有气体的原子的最外层电子数已经达到稳定结构,所以化学性质最不活泼。氟是最强的非金属元素,所以单质氟的氧化性最强。
(2)金属性越强,最高价氧化物的水化物的碱性越强,所以是氢氧化钠。非金属性越强,最高价氧化物的水化物的酸性越强。由于氟没有含氧酸,因此是高氯酸。氢氧化铝是两性氢氧化物。
(3)非金属性越强,相应氢化物的稳定性越强,所以是HF。
(4)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以钠的原子半径最大。
(5)镁是活泼的金属,氯是活泼的非金属,二者形成的化学键是离子键,其形成过程可表示为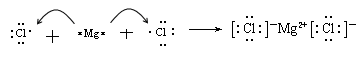 。
。
本题难度:一般
5、选择题 锎(Cf)是非常有用的中子源,1 mg Cf每秒约放出8.34×109个中子,在医学上常用作治疗恶性肿瘤的中子源。下列有关锎的说法错误的是
A.Cf原子中,中子数为154
B.Cf原子中,质子数为98
C.Cf原子中,电子数为98
D.锎元素的相对原子质量为252
参考答案:D
本题解析:考查原子的组成以及原子的表示方法。在表示原子组成时元素符号的左下角表示的是质子数,左上角表示的是质量数。所以该元素的质子数是98,质量数是252,因此中子数是252-98=154。,质子数等于核外电子数,所以电子数也是98。锎元素的相对原子质量是锎元素各种核素原子所占的一定百分比算出的平均值,所以选项D是错误的,答案选D。
本题难度:简单