1、填空题 (16分)2014年3月22日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的_______倍。
(2)炼金废水中含有络离子[Au(CN)2]+,与弱电解质碳酸的电离方式相似,[Au(CN)2]+也存在着两步电离,其电离出CN-有毒,CN-与H+结合生成毒性更强的HCN。 [Au(CN)2]+的一级电离方程式: ;在碱性条件下NaClO将废水中的CN-氧化成CO和N2,其反应的离子方程式为: 。
(3)某无色废水中可能含有Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关现象如下图所示:
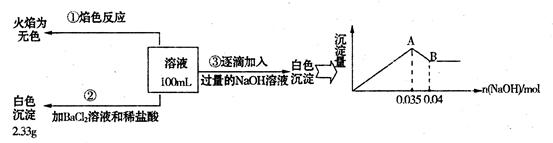
请根据上图回答下列问题:
①实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为________________。
②实验③中沉淀量由A→B过程中所发生反应的离子方程式为_________________ ___。
③试确定NO3-是否存在?_________________(填“存在”、“不存在”或“不确定”),若存在,试计算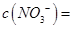 _________________(若不存在,此问不必作答)。
_________________(若不存在,此问不必作答)。
(4)聚合硫酸铁又称聚铁,其化学式为[Fe2(OH)n(SO4)(3
参考答案:
本题解析:
本题难度:困难
2、选择题 下列关于电解质液的正确判断是( )
A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存
C.由0.1mol?L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在关系BOH→B++OH-
D.由0.1mol?L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在关系A-+H2O?HA+OH-
参考答案:A.pH=12的溶液显碱性,HCO3-与OH-反应生成水和碳酸根离子,则不能共存,故A错误;
B.pH=0的溶液显酸性,H+、NO3-、SO32-发生氧化还原反应,则不能共存,故B错误;
C.由0.1mol?L-1一元碱BOH溶液的pH=10,则BOH为弱碱,存在电离平衡,则BOH?B++OH-,故C错误;
D.由0.1mol?L-1一元酸HA溶液的pH=3,HA为弱酸,则NaA溶液中存在水解离子反应为A-+H2O?HA+OH-,故D正确;
故选:D.
本题解析:
本题难度:一般
3、选择题 有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是( )
A.OH-、S2-、CO32-
B.MnO4-、SO42-、NO3-
C.Cl-、NO3-、SO42
D.AlO2-、MnO4-、SO42-
参考答案:B
本题解析:略
本题难度:简单
4、选择题 下列各组离子在所给的条件下能大量共存的是( )
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、Ba2+
C.有NO3-存在的强酸性溶液中:NH4+、Fe2+、I-、Br-
D.遇酚酞变红的溶液中:Na+、S2-、AlO2-、SO32-
参考答案:A.在pH=1的溶液显酸性,ClO-、Cl-发生氧化还原反应,则不能共存,故A错误;
B.SO42-分别与Ca2+、Ba2+结合生成沉淀,则不能共存,故B错误;
C.强酸性溶液中,NO3-、Fe2+发生氧化还原反应,NO3-、I-发生氧化还原反应,则不能共存,故C错误;
D.遇酚酞变红的溶液显碱性,该组离子之间不反应,能共存,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 下列各组离子一定能大量共存的是
[? ]
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+
C.在c(H+)=1×10-13mol/L的溶液中:Na+、S2-、SO32-、NO3-
D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-
参考答案:C
本题解析:
本题难度:一般