1、选择题 下列选项中,错误的是
A.酸性:HF<HCl
B.稳定性:SiH4>CH4
C.金属性:Be<K
D.气态氢化物的稳定性:H2Se<H2S
参考答案:B
本题解析:HF为弱酸,HCl为强酸,A项正确,C的非金属性比Si强,故B项错误;根据金属元素性质递变规律,C项正确;S的非金属性比Se强,D项正确.故答案:为B.
本题难度:一般
2、选择题 X,Y,Z是3种短周期元素,其中X,Y位于同一族,Y,Z处于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列说法正确的是
[? ]
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
参考答案:AD
本题解析:
本题难度:一般
3、填空题 下表为元素周期表的一部分
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
|
回答下列有关问题:
(1)写出元素符号:①______,④______,⑥______,⑦______.
(2)表中所列元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的是______.
参考答案:(1)根据元素周期表中的位置,相应的元素分别为:N、Mg、Si、S,故答案为:N;Mg;Si;S;
(2)根据元素周期律元素性质的递变规律可知,最容易失去电子的元素为Na,所以最活泼的金属元素Na;最容易得电子的元素为F,所以最活泼的非金属元素为F;根据核外电子排布规律可知Ar元素达到了稳定结构,故答案为:Na;F;Ar;
(3)最高价氧化物对应水化物酸性最强的元素为得电子能力最强的元素,由于F没有正价所以只能是Cl元素,其最高价氧化物对应水化物为HClO4;最高价氧化物对应水化物碱性最强的元素为失电子能力最强的元素为Na元素,其最高价氧化物对应水化物为NaOH;高中阶段所熟悉的两性的最高价氧化物对应水化物仅有Al(OH)3,故答案为:HClO4;NaOH;Al(OH)3.
本题解析:
本题难度:一般
4、填空题 下表列出前20号元素中的某些元素性质的一些数据
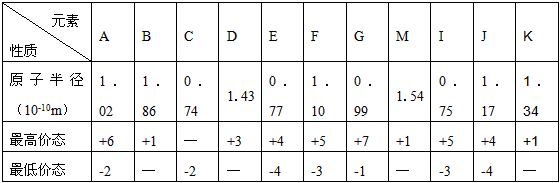
试回答下列问题
(1)以上11种元素中第一电离能最小的是_____________(填编号)。
(2)写出下列反应的化学方程式:M2C2与EC2反应__________________________。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是
__________(写一种分子式)。 比元素B原子序数大5的元素基态原子电子排布式是_____________。
(4)元素E与氢元素可形成分子式为E2H4的分子。其分子中E元素原子以________杂化成键,分子中共形成_______个σ键。
(5)C和I相比较,非金属性较弱的是_________(填元素名称),可以验证你的结论的是下列中的
_____________(填编号)。
a.气态氢化物的稳定性和挥发性
b.单质分子中的键能
c.两元素的电负性
d.含氧酸的酸性
参考答案:(1)B
(2)2Na2O2+2CO2==2Na2CO3+O2
(3)CCl4(或PCl3);1s22s22p63s23p63d54s1或[Ar] 3d54s1
(4)sp2;5
(5)氮;c
本题解析:
本题难度:一般
5、选择题 含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强
B.氢化物比HBr稳定
C.原子序数为34
D.最高价氧化物的水化物显碱性
参考答案:A、硒(Se)和硫同主族,同主族从上到下元素的非金属性逐渐减弱,所以硒(Se)的非金属性比硫弱,故A错误;
B、溴和硒同周期,同周期从左到右元素的非金属性逐渐增强,所以硒的氢化物不如HBr稳定,故B错误;
C、同主族相邻的3、4两周期元素原子序数差18,硫是16号,所以硒是34号,即原子序数为34,故C正确;
D、硒(Se)和硫同主族,硫的最高价氧化物的水化物硫酸是强酸性的,硒的最高价氧化物的水化物也显酸性,故D错误.
故选C.
本题解析:
本题难度:一般