1、填空题 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)需量取浓H2SO4的体积为??
(2)如果实验室有20mL、50mL、100mL量筒,应选用?mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将?(偏高、偏低、无影响)。
(3)将稀释并冷却后的硫酸溶液沿?注入?中,并用蒸馏水洗涤__________2~3次,洗涤液要?中,并摇匀。
(4)加水至距刻度?处,改用?加水,使溶液的凹液面正好跟刻度相平。
参考答案:(10分 除注明外每空1分)(1)14ml?(2)10?偏低
(3)玻璃棒? 500ml容量瓶(2分)?烧杯和玻璃棒?注入容量瓶?(4)1~2cm?胶头滴管
本题解析:(1)浓H2SO4的物质的量浓度c=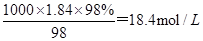 。根据稀释定律,稀释前后溶质的物质的量不变,所以若设浓硫酸的体积为xmL,则xmL×18.4mol/L=500mL×0.5mol/L,解得x=13.6ml。
。根据稀释定律,稀释前后溶质的物质的量不变,所以若设浓硫酸的体积为xmL,则xmL×18.4mol/L=500mL×0.5mol/L,解得x=13.6ml。
(2)由(1)可知所以应量取的浓硫酸体积是13.6mL,故选20mL量筒。量筒用水洗净后直接量取,未用浓硫酸润洗,即相当于是稀释浓硫酸,所以所配制的硫酸浓度偏低。
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用托20mL量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀即可。
(4)定容时加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
点评:该题是高考中的常见题型,属于基础性实验题的考查,有利于培养学生规范严谨的实验设计能力和动手操作,有利于调动学生的学习兴趣,激发学生的学习积极性。答题时注意理解配制原理,注意浓硫酸的稀释操作。
本题难度:一般
2、选择题 设阿伏加德罗常数的值为NA,则下列说法不正确的是(?)
A. Na参加氧化还原反应时电子转移NA
Na参加氧化还原反应时电子转移NA
B.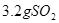 与
与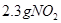 所含有的氧原子数相等
所含有的氧原子数相等
C.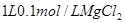 溶液中
溶液中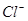 离子数为
离子数为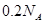
D.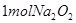 与足量水反应后转移的电子数为2NA
与足量水反应后转移的电子数为2NA
参考答案:D
本题解析:A.Na发生氧化还原反应时化合价由0升至+1价,故1molNa反应转移NA个电子。
B.3.2克二氧化硫与2.3克二氧化氮都是0.5mol。故氧原子数也相等。
C.氯化镁物质的量为:1L?0.1mol/L=0.1mol,故氯离子为0.2NA。
D.1mol过氧化钠与水反应转移的电子数为NA。
点评:注意一些物质反应的时电子转移特殊情况。
本题难度:一般
3、选择题 2.16 g X2O5中含有0.1 mol氧原子,则X的相对原子质量为(? )
A.21.6
B.28
C.14
D.31
参考答案:C
本题解析:n(X2O5)=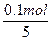 ="0.02" mol
="0.02" mol
由M= ="108" g·mol-1
="108" g·mol-1
Mr(X)=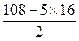 =14
=14
本题难度:简单
4、选择题 绿色植物是空气天然的“净化器”,研究发现,1亩柳杉每天可以吸收5mol SO2。则1亩柳杉每天吸收的SO2的质量为
A.320g
B.160g
C.64g
D.32g