1、实验题 (共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO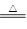 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
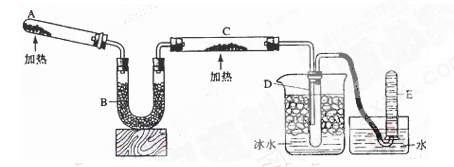
(1)A中发生反应的化学方程式是?。检验氨气通常采用的方法及现象是_________?______,?。
(2)B中加入的物质是?,其作用是?。
(3)实验时C中观察到的现象是?,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
参考答案:(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (1分)
2NH3↑+CaCl2+2H2O (1分)
用湿润的红色石蕊试纸(1分),试纸变蓝(1分)
(2)碱石灰,(1分)除去氨水中的水蒸汽(1分)
(3)黑色固体逐渐变成红色(1分),还原(1分)
(4)无水硫酸铜(1分),变蓝(1分)
防止E中的水蒸汽进入干燥管x,影响水的检验。(1分)
本题解析:(1)A中是制取氨气的,所以方程式为2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。
2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。
(2)和氧化铜反应的氨气应该是干燥的,所以B中用碱石灰除去氨气中的水蒸气。
(3)氨气具有还原性,在加热的条件下,能还原氧化铜,生成铜、氮气和水,所以现象是黑色固体逐渐变成红色。
(4)检验水蒸气常用无水硫酸铜,遇水即变成蓝色。用于装置E中水蒸气可能进入干燥管。影响水的检验,所以作用就是防止E中的水蒸汽进入干燥管x,影响水的检验。
本题难度:一般
2、选择题 吸入人体内的O2有2%转化为活性氧(如 ),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。下列说法中不正确的是(?)
),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。下列说法中不正确的是(?)
A.Se为ⅣA族元素
B.消除活性氧时,Na2SeO3?是还原剂
C.一定条件下,O2能置换出单质Se
D.H2Se的稳定性比HBr弱
参考答案:A
本题解析:略
本题难度:简单
3、选择题 在标准状况下,将NO2、NO、O2混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内HNO3的物质的量浓度的大小范围是(?)
A. <c(HNO3)<
<c(HNO3)<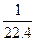
B. <c(HNO3)<
<c(HNO3)<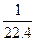
C. <c(HNO3)<
<c(HNO3)<
D.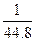 <c(HNO3)<
<c(HNO3)<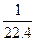
参考答案:C
本题解析:用极差法计算。若该气体由NO2和O2组成,按下式计算:
4NO2+O2+2H2O====4HNO3
4? 4
 V/22.4?
V/22.4? V/22.4
V/22.4
c(HNO3)= 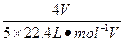 =
= ?mol·L-1
?mol·L-1
若该气体由NO和O2组成,则按下式计算:
4NO+3O2+2H2O====4HNO3
4? 3? 4
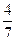 V/22.4?
V/22.4?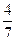 V/22.4
V/22.4
c(HNO3)=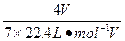 =
= ?mol·L-1
?mol·L-1
由于是NO2、NO、O2三者的混合气体,故c(HNO3)的大小范围应是: <c(HNO3)<
<c(HNO3)< 。
。
本题难度:简单
4、填空题 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2? g铜。
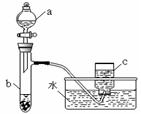
①请写出铜与稀硝酸反应的离子反应方程式?。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有?。
③仪器c中收集的气体主要是?。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是?g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a? mol? Fe和含有b? mol? HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是?。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+)?为3∶1,则b/a的值为?。
参考答案:(1)①3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑?②?酸性和强氧化性 ?③? NO?④? 4.9g
(2)①? 2a? <n<3a?②11/3
本题解析:(1)①3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
②?在反应中即生成了硝酸铜又生成了NO气体。所以体现了硝酸的酸性和强氧化性。
③? NO不溶于水,但可与空气反应。所以应采用排水法收集。
④因为n(Cu)=3.2g÷64g/mol=0.05mol.利用原子守恒,可以推得n(Cu(OH)2)=0.05mol?。所以m(Cu(OH)2)=0.05mol*98g/mol=4.9g?
(2)①因为反应后产物中是Fe(NO3)和Fe(NO3)2?。利用极端假设,若全部生成Fe(NO3)3,则a? mol? Fe(NO3)3?中NO3-的物质的量为3a? mol? .若全部生成Fe(NO3)2?,则a? mol? Fe(NO3)2?中NO3-的物质的量为2a? mol。
②因为发生的反应有Fe+4HNO3=Fe(NO3)3+NO+2H2O?和? 3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O?。又因为n(Fe3+)∶n(Fe2+)?为3∶1,可以假设n(Fe3+)=3mol,? n(Fe2+)=1mol。带入方程式求出n(HNO3)=12+8/3=44/3mol。而利用原子守恒反应物中n(Fe)=3+1=4mol.。则二者的物质的量之比为11/33反应的过程。
本题难度:一般
5、选择题 M(NO3)2受热分解的化学反应方程式为:2 M(NO3)2 ="=" 2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是
A.65 g·mol-1
B.64g·mol-1
C.40 g·mol-1
D.24 g·mol-1
参考答案:D
本题解析:由方程式2 M(NO3)2 ="=" 2MO+4NO2↑+O2↑可知,2mol M(NO3)2 完全分解生成5mol气体,因加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,所以可得M的摩尔质量是24 g·mol-1
本题难度:一般