1、选择题 下列反应的离子方程式书写正确的是
[? ]
A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-?+2OH-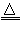 NH3↑+
NH3↑+
CO32-+2H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.酸性高锰酸钾溶液与双氧水反应:2MnO4-+H2O2+6H+===2Mn2++3O2↑+4H2O
D.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH===Ca2++2CH3COO-+2CO2↑+
2H2O
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.用惰性电极电解硫酸铜溶液: Cu2+ +2OH-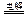 Cu↓ + H2↑+O2↑
Cu↓ + H2↑+O2↑
B.氨气通入饱和碳酸氢钠溶液中:H+ + NH3 = NH4+
C.铝溶于氢氧化钠溶液中,2Al +2OH-+2H2O=2AlO2-+3H2↑
D.溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br +OH-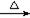 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
参考答案:
C
本题解析:
本题考查离子方程式的书写。用惰性电极电解硫酸铜溶液,阳极反应为:4OH--4e-=O2↑+2H2O,阴极反应为:Cu2++2e-=Cu,总反应式为:2Cu2++2H2O=2Cu+O2↑+4H+,A选项错误;氨气通入饱和碳酸氢钠溶液中发生的反应为:NH3+HCO3-=NH4++CO32-,B选项错误;溴乙烷在氢氧化钠水溶液条件下发生水解反应:C2H5Br +OH-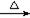 C2H5OH+Br-,D选项错误。
C2H5OH+Br-,D选项错误。
本题难度:一般
3、选择题 下列化学反应中,离子方程式表示正确的是( )
A.澄清石灰水检验CO2气体:CO2+Ca2++2OH-=CaCO3↓+H2O
B.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++SO42-=BaSO4↓
C.氢氧化铜与盐酸反应:H++OH-=H2O
D.Na2CO3溶液与醋酸溶液反应产生气体:CO32-+2H+=CO2↑+H2O
参考答案:A、二氧化碳能使澄清石灰水变浑浊,可以用澄清石灰水检验CO2气体,反应为:CO2+Ca2++2OH-═CaCO3↓+H2O,故A正确;
B、Ba(OH)2溶液与H2SO4溶液混合后,反应为:2OH-+2H++Ba2++SO42-═BaSO4↓+2H2O,故B错误;
C、氢氧化铜与盐酸反应为:2H++Cu(OH)2═2H2O+Cu2+,故C错误;
D、Na2CO3溶液与醋酸溶液的反应为:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 下列离子方程式中不正确的是(? )
A.FeBr2溶液中通人少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.酸性高锰酸钾溶液中加入草酸:2MnQ4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
C.硫代硫酸钠溶液中加入稀硫酸:2H++S2O32-=S↓+SO2↑+H2O
D.将氧气通入酸性碘化钾溶液中:2I-+O2+4H+=I2+2H2O
参考答案:D
本题解析:选项D中,电子的得失不守恒,应该是4I-+O2+4H+=2I2+2H2O,选项D不正确,其余都是正确的,所以答案选D。
本题难度:一般
5、选择题 下列叙述正确的是( )
A.将pH=12?Ba(OH)2与pH=14?NaOH溶液等体积混合后,混和液13<pH<14
B.常温时,0.1?mol?L-1HA溶液的pH>1,0.1?mol?L-1BOH溶液中
=1×1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH-)>c(H+)>c(A-)
C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:3SO2+2N+3Ba2++2H2O═3BaSO4↓+2NO↑+4H+
D.相同条件下,pH=5的?①NH4Cl溶液、②CH3COOH溶液、③稀盐酸溶液中由水电离出的c(H+):①>②>③
参考答案:A.pH=12?Ba(OH)2中c(OH-)=0.01moL/L,pH=14?NaOH溶液中c(OH-)=1moL/L,混合后的c(OH-)=0.01V+1V2V,介于0.1~1之间,则13<pH<14,故A正确;
B.常温时,0.1?mol?L-1HA溶液的pH>1,说明HA没有完全电离,应为弱酸,0.1?mol?L-1BOH溶液中c(OH-)c(H+)=1×1012,c(OH-)=0.1mol/L,BOH完全电离,为强碱,二者等体积混合生成BA,为强碱弱酸盐,溶液呈碱性,但A-水解程度较小,应存在c(A-)>c(OH-),故B错误;
C.过量SO2通入到Ba(NO3)2溶液中,Ba(NO3)2完全反应,应满足n(Ba2+):n(NO3-)=1:2,离子方程式为3SO2+2NO3-+Ba2++2H2O=BaSO4↓+2NO↑+4H++SO42-,故C错误;
D.NH4Cl为强酸弱碱盐,促进水的电离,而醋酸和盐酸抑制水的电离,pH相等,则想、醋酸和盐酸对水的抑制程度相等,应为①>②=③,故D错误.
故选A.
本题解析:
本题难度:简单