1、推断题 W.X.Y.Z四种短周期元素的原子序数为X>W>Z>Y,W原子的最外层电子数是X原子最外层电子数的一半,Y原子最外层电子数是次外层电子数的2倍,Z原子次外层电子数是最外层电子数的1/3,这四种元素原子核电荷数总和为37。
(1)元素X为__________,元素W为__________(填元素符号)
(2)这四种元素原子半径的大小为_______>______>______>______(下角注元素符号)
(3)W、X元素的最高价氧化物对应的水化物的碱性强弱为_______<_______(用化学式表示)
参考答案:(1)Mg;Na
(2)r(Na)>r(Mg)>r(C)>r(O)?
(3)Mg(OH)2<NaOH
本题解析:
本题难度:一般
2、填空题 下表是元素周期表的一部分,回答下列问题:
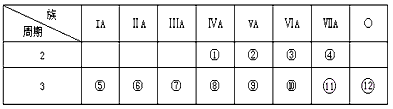
(1)写出①---⑿号元素的元素符号①___ ②___ ③____ ④____ ⑤____ ⑥____ ⑦___ ⑧____ ⑨____ ⑩___ 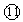 _____
_____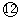 ____
____
(2)写出①、③两种元素形成的化合物有两种,化学式:_______ ,____________ 。
(3)写出①元素最高价氧化物的电子式和结构式________ ,__________ 。
(4)这些元素的最高价氧化物的对应水化物中________酸性最强;________碱性最强;能形成两性氢氧化物的元素是________ ,形成两性氢氧化物化学式_____________ 。
参考答案:(1)C;N;O;F;Na;Mg;Al;Si;P;S;Cl;Ar
(2)CO;CO2
(3) ;O=C=O
;O=C=O
(4)HClO4;NaOH;铝元素;Al(OH)3
本题解析:
本题难度:一般
3、推断题 短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素位于周期表第________周期,第________族。
(2)B与氢氧化钠溶液反应的化学方程式为:________________________。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为________,当生成
2mol二氧化氯时,转移电子________mol。
(4)溶液F在空气中长期放置生成H的化学方程式为:________________________。
(5)H的溶液与稀硫酸反应的现象为________________________。
参考答案:(1)三;ⅥA
(2)2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(3)硫酸钠(Na2SO4);2
(4)4Na2S+O2+2H2O=4NaOH+2Na2S2 (或2Na2S+O2+2H2O==4NaOH+2S、Na2S+S=Na2S2)
(5)溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体
本题解析:
本题难度:困难
4、选择题 元素性质随原子序数的递增呈周期性变化的本质是( )
A.元素的相对原子质量逐渐增大,量变引起质变
B.原子的电子层排布呈周期性变化
C.原子半径呈周期性变化
D.原子核外电子排布呈周期性变化
参考答案:A、随着原子序数的递增,元素的原子的相对原子质量增大,但不呈现周期性的变化,则不能决定元素性质出现周期性变化,故A错误;
B、电子层排布呈周期性变化,是原子的核外电子排布呈现周期性的变化而引起,B错误;
C、元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故C错误;
D、因原子的核外电子排布中电子层数和最外层电子数都随原子序数的递增而呈现周期性变化,则引起元素的性质的周期性变化,故D确.
故选:D.
本题解析:
本题难度:简单
5、选择题 下列结论错误的是( )
①微粒半径:K+>Al3+>S2->C1-
②氢化物的稳定性:HF>HC1>H2S>PH3>SiH4
③离子的还原性:S2->C1->Br->I-?④氧化性:C12>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO?⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
A.只有①
B.①③
C.②④⑤⑥⑦
D.①③⑤
参考答案:①K+、S2-、C1-原子核外电子排布相同,核电核数S2-<C1-<K+,则半径S2->C1->K+,离子的原子核外电子层数越多,半径越大,核外电子层数最小,则半径最小,则有S2->C1->K+>Al3+,故①错误;
②非金属性:F>Cl>S>P>SI,元素的非金属性越强,对应的氢化物越稳定,则氢化物的稳定性:HF>HC1>H2S>PH3>SiH4,故②正确;
③非金属性:Cl>Br>I>S,元素的非金属性越强,对应阴离子的还原性越弱,则还原性:C1->Br->I->S2-,故③错误;
④非金属性:C1>S>Se>Te,元素的非金属性越强,对应单质的氧化性越强,则氧化性:C12>S>Se>Te,故④正确;
⑤非金属性:S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:H2SO4>H3PO4>H2CO3,又H2CO3酸性大于HClO,
则有酸性:H2SO4>H3PO4>H2CO3>HClO,故⑤正确;
⑥因同周期元素从左到右元素的非金属性逐渐增强,则有O>N、P>Si,同主族元素从上到下元素的非金属性逐渐减弱,则N>P,所以有非金属性:O>N>P>Si,故⑥正确;
⑦同周期元素从左到右元素的逐渐减弱,则金属性Ca<K,同主族元素从上到下元素的金属性逐渐增强,则金属性Be<Mg<Ca,所以金属性:Be<Mg<Ca<K,故⑦正确.
故选B.
本题解析:
本题难度:一般