1、推断题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为___________,元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_________________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。

(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量
215kJ。 该反应的热化学方程式为______________________________。
参考答案:(1)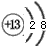 ;ⅦA
;ⅦA
(2)
(3)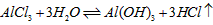
(4)①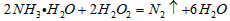 ;②a和c
;②a和c
(5)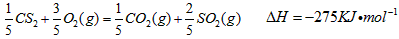
本题解析:
本题难度:一般
2、填空题 下表为元素周期表的一部分,请回答有关问题

(1)⑤和⑧的元素符号是__________和________
(2)表中最活泼的金属是__________,非金属性最强的元素是___________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是___________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:______________,______________
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:______________
参考答案:(1)Si;Ar
(2)K;F
(3)A1;2A1(OH)3+3H2SO4==Al2(SO4)3+6H2O;Al(OH)3+KOH==KAlO2+2H2O[或Al(OH)3+KOH==
KAl(OH)4]?
(4)将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强
本题解析:
本题难度:一般
3、选择题 关于手手~手九号元素的性质比较中:①元素的最高正化合价依次升高;②元素的非金属性逐渐增强;③元素的金属性依次减弱;④元素的最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强,正确的说法是( )
A.只有①②正确
B.只有③④正确
C.全都不正确
D.全都正确
参考答案:①11~17号元素从左到右原子核外电子层数之间增多,最高化合价以此升高,故①正确;
②同周期元素从左到右元素的非金属性逐渐增强,故②正确;
③同周期元素从左到右元素的金属性依次减弱,故③正确;
④同周期元素从左到右元素的金属性依次减弱,元素的最高价氧化物对应的水化物碱性逐渐减弱,同周期元素从左到右元素的非金属性逐渐增强,元素的最高价氧化物对应的水化物酸性逐渐增强,故④正确.
故选D.
本题解析:
本题难度:简单
4、填空题 在下列各组元素中,除一种元素外,其余都可能按某种共性归属一类,请先选出各组的例外元素,并将该组其他元素的可能归属按6种类型把字母填入表内?
归属类型:A.主族元素?B.过渡元素?C.同周期元素?D.同族元素 ?E.金属元素?F.非金属元素
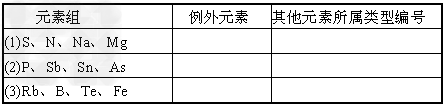
参考答案:(1)N;C?
(2)Sn;D?
(3)Fe;A
本题解析:
本题难度:一般
5、选择题 A和B是前三周期元素,它们的离子A2-和B3+具有相同的核外电子层结构,下列说法中正确的是
A.原子序数A>B
B.原子半径A>B
C.离子半径A2->B3+
D.质量数为A>B
参考答案:C
本题解析:由离子的结构关系易知B在A的下一周期,原子序数B>A,原子半径B>A;离子半径A2->B3+;质量数应是B>A.
本题难度:简单