1、选择题 甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是? ( )。
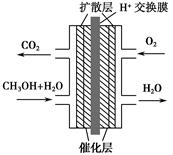
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
参考答案:C
本题解析:外电路中电子从负极流向正极,内电路H+从负极移向正极,B、D错误;O2在正极发生还原反应,A错误;甲醇在负极发生氧化反应,负极反应式为CH3OH+H2O-6e-=CO2↑+6H+。
本题难度:一般
2、填空题 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用。
(1)请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。
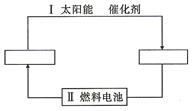
(2)从能量转换的角度看,过程Ⅱ应是_________能转化为_________能。
(3)该燃料电池中以KOH溶液作电解质溶液,请写出该电池的电极反应式:
负极____________________________________;
正极____________________________________。
该燃料电池的优点为 ?
参考答案:(1)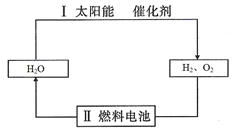 (2)化学能;电能
(2)化学能;电能
(3)H2-2e-+2OH-=2H2O;O2+4e-+2H2O=4OH-?氢氧燃料电池的能量转化率高,且生成物是水,没有污染
本题解析:(1)在催化剂的作用下,利用太阳能将水分解生成氢气和氧气,然后该题氢氧燃料电池再将化学能转化电能,则循环过程是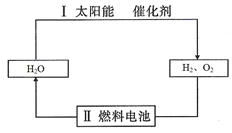 。
。
(2)从能量转换的角度看,过程Ⅱ应是化学能转化为电能。
(3)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。据此可知氢气在负极通入,氧气在正极通入,则电极反应式分别是H2-2e-+2OH-=2H2O;O2+4e-+2H2O=4OH-。氢氧燃料电池的能量转化率高,且生成物是水,没有污染。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和训练,旨在考查学生灵活运用原电池原理解决实际问题的能力。该题的关键是明确原电池的工作原理,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
3、选择题 X、Y、Z、M、N代表五种金属,它们存在以下反应:
①水溶液中:X+Y2+=X2++Y
②只有Z能与冷水发生如下反应:Z+2H2O(冷水)=Z(OH)2+H2↑
③当M、N分别为电极与稀硫酸组成原电池时,负极的电极反应为:M-2e-=M2+
④N可以溶于稀硫酸,X不能被稀硫酸氧化
则这五种金属的活泼性由强到弱的顺序是( )
A.Z>X>Y>N>M
B.Z>M>N>X>Y
C.Z>Y>X>M>N
D.Y>M>N>Z>X
参考答案:①根据X+Y2+=X2++Y知,X的活动性顺序大于Y;
②Z能和水反应置换出氢气,则Z的活动性最强;
③当M、N分别为电极与稀硫酸组成原电池时,M失电子,则M的活动性顺序大于N;
④N可以溶于稀硫酸,则N处于氢元素之前,X不能被稀硫酸氧化,则X处于氢元素之后,
根据以上分析知,金属的活动性强弱顺序是:Z>M>N>X>Y,
故选B.
本题解析:
本题难度:一般
4、选择题 已知可逆反应AsO43-+2I-+2H+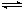 AsO33-+I2+H2O,设计如下图装置,进行下述操作:
AsO33-+I2+H2O,设计如下图装置,进行下述操作:
①向(Ⅱ)烧杯中逐滴加入浓盐酸,发现微安表(G)指针偏转;②若改往(Ⅱ)烧杯中滴加40%NaOH溶液,发现微安表指针与①的偏转方向相反。下列有关说法不正确的是
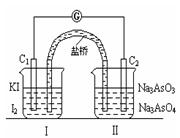
A.①操作过程中C1棒上发生的反应为2I--2e-=I2
B.②操作过程中导线上电子定向移动方向由C2→C1
C.若将微安表换成电解冶炼铝装置,在②操作过程中与C2棒连接的电极上产生氧气
D.若将微安表换成电解饱和食盐水装置以模拟氯碱工业,在①操作过程中与C1棒连接的可以是Pt-Fe合金电极
参考答案:C
本题解析:①操作过程中C1棒是负极,A正确。加入氢氧化钠平衡向逆反应方向移动,所以C2棒是负极,B正确。C2棒是负极,与之相连的电极是阴极,铝离子放电,所以C是错误的。①操作过程中C1棒是负极,与之相连的电极是阴极,因此D正确。答案选C。
本题难度:一般
5、选择题 下图是某同学做Zn-Cu原电池实验所做的读书卡片记录,其中描述合理的组合是

A.①②③
B.②③④
C.③④⑤
D.④⑤⑥
参考答案:C
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极失去2个电子。铜是正极,溶液中的氢离子得到电子,所以答案选C。
本题难度:一般