1、选择题 对于某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42–
B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32–
C.无色溶液焰色反应呈黄色,结论:试液是钠盐溶液
D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
参考答案:D
本题解析:试题分析:A、加入氯化钡溶液产生的白色沉淀可能是AgCl,错误;B、加入稀盐酸产生无色气体可能是CO2或SO2,再说能与盐酸反应产生CO2气体的还可能是HCO3–,错误;C、无色溶液焰色反应呈黄色,只能说明该溶液中含有Na+,可能是钠盐溶液或氢氧化钠溶液。D、能使湿润红色石蕊试纸变蓝的气体只有NH3,能与强碱溶液反应产生NH3则说明溶液中含有NH4+,故D正确。
考点:考查常见离子的检验。
本题难度:一般
2、填空题 (14分)稀土元素(包括钇、钪和镧系等金属元素)是能源、信息等领域的领域的关键材料,我国稀土产量占世界的85%以上。镧(La)镍(Ni)的某种合金可表示为LaNi5,它具有神奇的吸氢能力(最大储氢量达到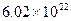 个氢原子/cm3),反应如下:LaNi5H6
个氢原子/cm3),反应如下:LaNi5H6 LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
LaLi5+3H2,其中固体LaNi5H6具有导电必,被称为金属型氢化物。
试回答:
(1)氢位于周期表的?族,该族元素的金属性随原子序数递增而?;
(2)对于反应LaNi5H6 LaLi5+3H2,保持温度不变,当平衡?(填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡?(填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是?;
LaLi5+3H2,保持温度不变,当平衡?(填“正向移动”或“逆向移动”)时,LaNi5的吸氢量会增加。温度升高后,若平衡常数K值变大,平衡?(填“不移动”、“向正向移动”或“向逆向移动”)。LaNi5吸氢的适宜条件是?;
(3)镍可用于制镉镍电池,但镉元素对环境有污染,为此,人们开发了碱性氢镍电池,它利用LaNi5良好的吸氢能力,用固体NaLi5H6作负极反应物,其中氢元素的化合价为?,电池放电时,发生氧化反应的电极反应式为?。电池充电时,每转移2mole-,最多形成?cm3LaNi5H6;
(4)已知液态氢的密度为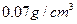 ,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为?。
,则相同体积LaNi5(以最大吸氢量计)和液态氢的含氢量之比为?。
参考答案:
(1)IA(1分);增强(1分)
(2)逆向移动(1分);向正向移动(1分);加压、低温(2分)
(3)0(1分);LaNi5H6-6e-+6OH-=LaNi5+6H2O(3分);20(2分)
(4)10:7(2分)
本题解析:略
本题难度:一般
3、选择题 2012年诺贝尔化学奖获得者利用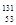 I研究G蛋白偶联受体,下列说法正确的是
I研究G蛋白偶联受体,下列说法正确的是
A.I元素的质量数是131
B.I元素的中子数是78
C.I原子5p亚层有一个未成对电子
D.I原子有53个能量不同的电子
参考答案:C
本题解析:A、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,所以该核素的质量数是131,元素没有质量数,A不正确;B、中子数+质子数=质量数,所以该核素的中子数=131-53=78,同样元素没有中子数,B不正确;C、根据构造原理可知,I元素的核外电子排布式是1s22s22p63s23p63d104s24p64d105s25p5,所以I原子5p亚层有一个未成对电子,C正确;D、由于同一个能级上的电子能量是相同的,所以I原子不可能53个能量不同的电子,D不正确,答案选C。
本题难度:一般
4、选择题 氢核聚变能产生大量的能量,而高纯度铍(Be)是制造核聚变反应装置中最核心的部件之一的屏蔽包的主要材料。据中新网2009年2月6日报道,我国科学家己成功地掌握了获取高纯度铍的技术。下列有关说法错误的是
A.10Be、9Be、8Be核内质子数均是4
B.Be元素在元素周期表的p区
C.氢核聚变后会产生新元素
D.从矿物中提取单质铍的过程中铍一定被还原
参考答案:B
本题解析:10Be、9Be、8Be互为同位素,核内质子数均是4,A正确;Be元素在元素周期表的s区,B不正确;核裂变会产生新的元素,C正确;铍是活泼的金属,金属冶炼一定是被还原的过程,D正确,答案选B。
点评:该题是常识性知识的考查,以新科技为载体,重点考查学生灵活运用基础知识解决实际问题的能力,有利于激发学生的学习兴趣和学习积极性。
本题难度:简单
5、选择题 X、Y、Z、W、R是五种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一主族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是(?)
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物对应的水化物都是强酸
参考答案:C
本题解析:X是周期表中原子半径最小的元素,即为H元素,Y原子最外层电子数是次外层电子数的3倍,则为O元素,R、Y处于同一主族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,结合Z、W、R处于同一周期,且原子序数Z、W、R依次增大,推出Z为Na元素,W为Al元素。A项,离子半径依次减小,不正确;B项,X可与Y形成H2O2,不正确;C项,正确;D项,元素W的最高价氧化物对应的水化物是两性物质,不正确。
本题难度:一般