1、填空题 (4分)两性氢氧化物是(写化学式)?。
写出该物质与氢氧化钠溶液反应的化学反应方程式为?
参考答案:(1)Al(OH)3?(2)Al(OH)3? + NaOH? =? NaAlO2? +2H2O
本题解析:两性氢氧化物是指既能与酸反应生成盐和水又能与碱反应生成盐和水的氢氧化物;中学化学中常见的为Al(OH)3;与氢氧化钠溶液反应的化学反应方程式为Al(OH)3? + NaOH? =? NaAlO2? +2H2O
本题难度:一般
2、选择题 下列有关钠及其化合物的说法中正确的是(?)
A.在Na2SO4、Na2O以及Na2O2中,阳离子与阴离子的个数比均为2∶1
B.实验桌上金属钠着火不能用常规灭火器灭火,可以选择用湿布盖灭
C.长距离运输鱼苗,最好在水中加入一定量的Na2O2,以起到供氧和杀菌的作用
D.金属钠和钾都保存在煤油中,所以金属锂也应该保存在煤油中
参考答案:A
本题解析:A项,Na2SO4中存在Na+和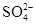 ,Na2O中存在Na+和O2-,Na2O2中存在Na+和
,Na2O中存在Na+和O2-,Na2O2中存在Na+和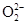 ;B项,由于金属钠与水反应生成H2,所以钠着火不应用湿布盖灭,应用沙土盖灭;C项,虽然Na2O2能起到供氧和杀菌作用,但产物NaOH具有强腐蚀性;D项,由于金属锂的密度比煤油小,所以锂不能保存在煤油中,而应用石蜡密封,故选A项。
;B项,由于金属钠与水反应生成H2,所以钠着火不应用湿布盖灭,应用沙土盖灭;C项,虽然Na2O2能起到供氧和杀菌作用,但产物NaOH具有强腐蚀性;D项,由于金属锂的密度比煤油小,所以锂不能保存在煤油中,而应用石蜡密封,故选A项。
本题难度:一般
3、实验题 (12分)甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量Na2O)的纯度。

(1)甲组同学拟选用左图实验装置完成实验:
①写出实验中所发生反应的化学方程式_____________________________________________
②该组同学必须选用的装置的连接顺序是:A接(?)(?)接(?)(?)接(?)(填接口字母,可不填满。)
③实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其旋塞,一会儿后水也不能顺利滴入锥形瓶。请你帮助分析原因:? _____________________________________? __。
④实验结束时,该组同学应怎样测量实验中生成的氧气的体积??。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是:____________________________、_________?。
②若实验中样品的质量为wg,实验前后碱式滴定管中液面读数分别为V1、V2 (换算成标况)。则样品的纯度为____________________________(含w、V的表达式)。
参考答案:(12分)(1)①2Na2O2+2H2O===4NaOH+O2↑;(1分) Na2O+H2O="==2NaOH" (1分)
②EDG (2分)?
③样品与水反应激烈,放热且生成气体,使锥形瓶中气体压强变大(2分)?
④待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氧气的体积。(2)
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利滴下;滴入锥形瓶的水的体积等于进入分液漏斗的气体体积,从而消除由于加入水引起的氧气体积误差。(2)?
②?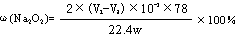 ?(2分)
?(2分)
本题解析:(1)①氧化钠和过氧化钠都易和水反应,方程式分别是2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH。
②甲组的实验原理是通过测量过氧化钠生成的氧气体积,来计算过氧化钠的质量,因此正确的顺序是AEDG。
③由于样品与水反应激烈,放热且生成气体,使锥形瓶中气体压强变大,因而水不易滴下。
④再测量氧气的体积时,必须保证容器内外压强是相同的,所以正确的操作是待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氧气的体积。
(2)①根据装置的结构可知,导管a可以使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利滴下;滴入锥形瓶的水的体积等于进入分液漏斗的气体体积,从而消除由于加入水引起的氧气体积误差。
②根据滴定管的读数可知,生成的氧气体积是(V2-V1)ml,所以样品中过氧化钠的质量是 ,所以样品的纯度是
,所以样品的纯度是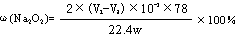 。
。
本题难度:一般
4、填空题 呼吸面具中有Na2O2,可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2,也能吸收CO2生成碳酸盐和氧气。
(1)写出KO2与CO2反应的化学方程式___________________________________________。
(2)1 kg Na2O2和1 kg KO2分别和CO2反应生成O2的质量分别为__________________。
(3)你认为选用_____________作为氧化剂更合适。理由是_____________________________。
参考答案:(1)4KO2+2CO2====2K2CO3+3O2
(2)205 g、338 g
(3)KO2?同质量的KO2和Na2O2与CO2反应,KO2产生的O2多
本题解析:(2)2Na2O2+2CO2====2Na2CO3+O2
2×78 g? 32 g
1×103 g? m(O2)
m(O2)=32 g×1×103 g/(2×78) g=205 g
4KO2+2CO2====2K2CO3+3O2
4×71 g? 96 g
1×103 g? m′(O2)
m′(O2)=96 g×1×103 g/(4×71) g=338 g
本题难度:简单
5、选择题 对于①ag纯净的Na2CO3,②ag Na2CO3和NaHCO3的混合物;下列各种情况的描述正确的是(?)
A.与足量盐酸反应时,②放出的CO2多
B.与盐酸反应时,②消耗盐酸多
C.配成等体积的溶液,②的pH大
D.配成等体积的溶液,②的c(Na+)大
参考答案:A
本题解析:略
本题难度:一般