| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《水的电离平衡》试题预测(2019年最新版)(八)
参考答案:(1)24.00 本题解析:正确读取读数,目光平视,刻度为24.00ml;滴定终点的判断,当变色稳定,半分钟不变色时说明达到滴定重点;碘盐碘点元素的含量用碘酸钾的质量与碘元素的质量分数相乘,逐步计算ω= 本题难度:困难 2、选择题 室温下,某溶液中由水电离出来的c(OH-)=10-12mol·L-1,则该溶液的溶质不可能是 |
参考答案:C
本题解析:水电离出来的c(OH-)=10-12mol·L-1,说明水的电离受到了抑制,那么溶液可能是酸或碱的溶液,故选C,NH4NO3会发生水解促进水的电离。
考点:水的电离的影响因素。
本题难度:一般
3、选择题 下列电离方程式的书写错误的是( )
A.NaHSO4=Na++H++SO42-
B.MgCl2=Mg2++Cl2-
C.Ba(OH)2=Ba2++2OH-
D.Na2SO4=2Na++SO42-
参考答案:B
本题解析:
本题难度:简单
4、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为 ( )
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠过量,反应后溶液中OH-的浓度为0.01mol/L。所以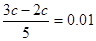 ,解得c=0.05mol/L。答案是C。
,解得c=0.05mol/L。答案是C。
本题难度:一般
5、选择题 下列有关说法正确的是
A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S)
B.等浓度的氨水和氯化铵按体积比2:3混合,溶液中存在:2c(Cl-)=3[c(NH4+)+c(NH3.H2O)]
C.0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+)
D.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的值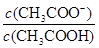 增大到原来的10倍
增大到原来的10倍
参考答案:D
本题解析:A、根据质子守恒得出:c(OH—)=c(H+) + c(HS—) +2c(H2S),错误;B、设浓度均为1mol/L,氨水的体积为2L,氯化铵的体积3L,根据N元素守恒:c(NH4+)+c(NH3.H2O)=1mol/L,c(Cl-)=0.6mol·L-1,因此5c(Cl-)=3[c(NH4+)+c(NH3.H2O)] ,错误;C、不知HA是强酸还是弱酸,若为强酸,c(Na+)=c(A—)>c(OH—)=c(H+),若为弱酸,c(Na+)>c(A—)>c(OH—)>c(H+),错误;D、根据电离平衡常数K=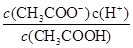 ,推导出
,推导出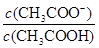 =c(H+)×K,pH从3.0升到4.0时,
=c(H+)×K,pH从3.0升到4.0时,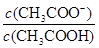 增大到原来的10倍,正确。
增大到原来的10倍,正确。
考点:考查离子浓度大小的比较及电离平衡常数。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《中和滴定实.. | |