1、选择题 下列关于铜电极的叙述,正确的是
[? ]
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
参考答案:C
本题解析:
本题难度:一般
2、选择题 一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月。该电池反应为:2CH3OH?+?3O2?+4OH- 2CO32-?+6H2O,则有关说法不正确的是
2CO32-?+6H2O,则有关说法不正确的是
[? ]
A.充电时阴极发生氧化反应
B.放电时负极的电极反应为CH3OH?+8?OH--6e-?=?CO32-?+?6H2O
C.通入0.25mol氧气并完全反应后,有1?mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH升高
参考答案:D
本题解析:
本题难度:一般
3、填空题 A、B、C三种强电解质,它们在水中电离出的离子如下表所示

下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。
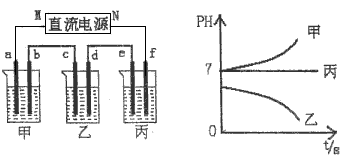
接通电源,经过一端时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的________极(填写“正”或“负”),甲、乙电解质分别为________、________(填写化学式)。
(2)写出d电极上发生反应的电极反应式________________。
(3)若电解后甲溶液的体积为25L,且产生的气体全部逸出则该溶液常温时的pH为________。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式:________________。
(5)要使电解后丙中溶液恢复到原来的状态,应加入_______物质。(填写化学式)
参考答案:(1)负;NaCl;AgNO3
(2)4OH--4e-==2H2O+O2
(3)12
(4)2H2O+O2+4e-==4OH-
(5)H2O
本题解析:
本题难度:一般
4、填空题 选考题【化学一一选修化学与技术】(15分)以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1. 1
| 3. 2
|
Zn2+
| 5. 2
| 6. 4
|
Fe2+
| 5. 8
| 8. 8
|
(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是 (选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3;d.ZnSO4;pH应调整到 ;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 ;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 ;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
参考答案:(1)2Fe2++H2O2+2H+ = 2Fe3++2H2O(2分)
(2)d(2分);3.2 ≤ pH < 5.2 (或:约为4) (2分)
(3)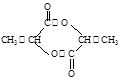 (2分);
(2分); 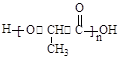 (2分)
(2分)
(4)O2(或氧气)(1分); [Zn(OH)4]2-+2e-="Zn" + 4OH-(2分)
(5)氧化铜、氧化亚铁不溶于碱溶液中
本题解析:(1)双氧水具有强氧化性,能把亚铁离子氧化为铁离子,离子方程式为2Fe2++H2O2+2H+ = 2Fe3++2H2O。
(2)由于不能引入杂质,因此X不能选择硫酸锌,答案爱信d;调节pH的目的是沉淀铁离子,而保留锌离子,所以pH应调整到3.2≤pH<5.2;
(3)2分子2-羟基丙酸分子酯化反应生成丙交酯,结构简式为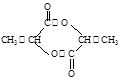 ;2-羟基丙酸分子中羟基和羧基,发生缩聚反应生成聚乳酸,结构简式为
;2-羟基丙酸分子中羟基和羧基,发生缩聚反应生成聚乳酸,结构简式为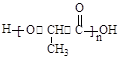 。
。
(4)以石墨作电极电解时,阳极是溶液中的氢氧根离子放电,产生的气体为O2;阴极得到电子,电极反应式为[Zn(OH)4]2-+2e-="Zn" + 4OH-;
(5)由于氧化铜、氧化亚铁不溶于碱溶液中而能溶于酸溶液中,所以炼锌烟尘采用碱溶,而不采用酸溶后电解。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
5、选择题 不考虑气体溶解的情况下,把分别盛有熔融的氯化钾、硫酸水溶液、熔融氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出气体的总物质的量之比为
A.1:1:1? B2:2:1.? C.2:3:1? D.4:3:1
参考答案:C
本题解析:这是一道有关电化学的计算题,一般根据电子得失守恒就能快速解答。根据串联电路的各电极的得或失的电子数相等,设转移了4mol电子,则电解熔融的氯化钾可得2molCl2,电解硫酸水溶液可得2molH2、1molO2,电解熔融氧化铝可得1molO2,所以析出气体的总物质的量之比为2:3:1,选C。
本题难度:简单