1、填空题 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。
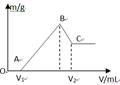
(1)写出BC过程的离子反应方程式?
(2)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(3)滴入的NaOH溶液_____mL时,溶液中的Mg2+和Al3+刚好沉淀完全。
(4)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
(5)当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,能观察到的现象为?,写出该过程反应的离子方程式?。
参考答案:(1)Al(OH)3 + OH-? ==AlO2- +2H2O (2) 0.04? 460 (3) 400?(4)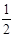 ≤a<1
≤a<1
(5)白色胶状沉淀? AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-
本题解析:(1)由图可以知道,刚开始为酸碱中和,从V1开始,边有沉淀生成,而由于氢氧化铝为两性物质,故BC过程的离子反应方程式为:Al(OH)3 + OH-? ==AlO2- +2H2O;(2)当V1=140mL时,则与镁铝反应的盐酸的量n=0.1×4-0.14×1=0.26mol,设镁为amol,铝为bmol,即a+b=0.1,2a+3b=0.26,联立解得a=0.04,b=0.06,所以混合物中n(Mg)=0.04mol,即从V1到V2所需要的氢氧化钠的物质的量n=0.04×2+0.06×4=0.32,故需要氢氧化钠的体积为0.32/1=0.32L=320mL,所以V2=140+320=460mL;溶液中的Mg2+和Al3+刚好沉淀完全,为图中的b点,故需要氢氧化钠的量n=0.04×2+0.06×3=0.26,故需要氢氧化钠的体积为0.26/1=0.26L=260mL,所以V2=140+260=400mL,故滴入的NaOH溶液为100mL时,溶液中的Mg2+和Al3+刚好沉淀完全;(4)0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,100mL4mol/L的盐酸中氢离子的物质的量为0.4mol,而Mg、Al转化为离子,而450mLNaOH溶液中氢氧根的物质的量为0.45mol,故只能有0.45-0.4=0.05mol的氢氧根来溶解氢氧化铝,根据
Al(OH)3 + OH-? ==AlO2- +2H2O可以知道,Al(OH)3的物质的量不能超过0.05mol,所以即a要大于等于0.05/0.1=0.5,而有不能大于0.1/0.1=1,即a的取值范围为: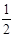 ≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
点评:本题考查了铝及其化合物的相关计算,该题要求学生具有较强的数学分析能力,该题难度较大。
本题难度:一般
2、实验题 下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________(用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将 的上述溶液沿玻璃棒注入___________中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度线1-2cm时,改用 加水,使溶液凹液面跟刻度相平。
(6)用“偏高”“偏低”或“无影响”填空:
① 定容时,观察液面俯视: ;
② 摇匀后,液面低于刻度线,没有再加水: ;
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理: 。
参考答案:(1)13.6mL (2)15 (4)冷却至室温,500mL容量瓶
(5)胶头滴管, (6)①偏高 ②无影响 ③无影响
本题解析:(1)98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL,根据
c=1000ρw/M,可以得到该浓硫酸的浓度=1000×1.84×98%÷98=18.4mol/L,c1V1=c2V2,可以得到18.4×V1=0.5×500,所以V1=13.6mL(注意量筒精确到0.1mL);(2)如果实验室有15mL、20mL、50mL量筒,应选用15mL的量筒,因为这样误差最小;(4)(5)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌,由于浓硫酸溶于水的过程为放热反应,所以必须使溶解后的溶液冷却至室温,然后沿玻璃棒注入500mL容量瓶中,并并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀,加水至距刻度线1-2cm时,改用胶头滴管(易于控制),加水,使溶液凹液面跟刻度相平;(6)① 定容时,观察液面俯视,则滴加的水小于实际的体积,所配置的溶液的浓度偏高;② 摇匀后,液面低于刻度线,没有再加水,对配置溶液的浓度不产生影响;③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理,因为在设计的时候就已经考虑到会有一点的硫酸残留在量筒上,所以该问题已经在设计的时候解决了,即对配置溶液的浓度不产生影响。
考点:溶液的配置
点评:本题考查了溶液的配置,溶液的配置是高中的基础实验之一,是高考常考的考点,本题难度适中。
本题难度:一般
3、选择题 下列各组物质中,所含分子数相同的是
A.10g H2和10g O2
B.5.6LN2(标准状况)和11gCO2
C.9g H2O和1mol Br2
D.224ml H2(标准状况)和0.1mol N2
参考答案:B
本题解析:氢气和氧气的摩尔质量不同,所以在质量相等的条件下,二者的分子数不同;B中气体的物质的量都是0.25mol,所以二者的分子数相等;9g水是0.5mol,所以选项C中分子数不相等;标准状况下,224ml氢气是0.01mol,因此D中分子数不相等,答案选B。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1 mol Al分别放入足量的冷的浓HNO3稀HNO3中,反应后转移的电子均为3NA个
C.各5.6g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.2.7g铝与足量的NaOH溶液反应,转移的电子总数为NA
参考答案:A
本题解析:A正确;B错,Al放入足量的冷的浓HNO3稀中会发生钝化;C错,5.6g铁与盐酸反应电子转移总数为0.2NA,与氯气反应电子转移总数为0.3NA;D错,2.7g铝与足量的NaOH溶液反应,转移的电子总数为0.3NA;
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为NA
B.78g 苯含有C=C双键的数目为3NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1N
参考答案:C
本题解析:ClO-能发生水解,A错;苯中没有C=C,B错;3mol NO2与水反应电子转移为什2mol,D错;答案选C。
本题难度:一般