正确
参考答案:A
本题解析:B中电子的得失不守恒,错误。C中氢氧化钠不足,只生成氢氧化铝沉淀,不正确。镁是活泼的金属,在溶液中镁离子不可能得到电子,D不正确,答案选A。
本题难度:一般
2、选择题 判断下列说法是否正确:
(1)Ba2++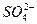 ====BaSO4↓,表示所有钡盐与硫酸或硫酸盐的反应(?) ====BaSO4↓,表示所有钡盐与硫酸或硫酸盐的反应(?)
(2)2H++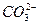 ====H2O+CO2↑,表示所有酸与碳酸盐的反应(?) ====H2O+CO2↑,表示所有酸与碳酸盐的反应(?)
参考答案:(1)×?(2)×
本题解析:(1)BaCO3与H2SO4的反应,就不能用该离子方程式表示,(1)错误:
BaCO3+H2SO4====BaSO4↓+H2O+CO2↑
BaCO3和BaSO4难溶于水,不能拆为离子形式。
(2)醋酸等弱酸与石灰石的反应,就不能用该离子方程式表示,(2)错误。
2CH3COOH+CaCO3====2CH3COO-+Ca2++H2O+CO2↑
CH3COOH是弱电解质,不能拆分为离子形式。
本题难度:简单
3、填空题 (1)氢氧化铝具有两性,分别写出其与酸、碱反应的离子方程式:______;______;
(2)乙炔可与HCl反应生成氯乙烯,氯乙烯发生聚合反应制造聚氯乙烯塑料,
写出相应的化学反应方程式:______;______.
(3)写出用铝粉和Fe2O3制金属铁的化学方程式:______.
参考答案:(1)氢盐化铝与盐酸反应生成氯化铝和水,离子反应为Al(OH)3+3H+=Al3++3H2O,
与氢氧化钠反应生成偏铝酸钠和水的离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(2)乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应生成聚氯乙烯,化学反应分别为CH≡CH+HCl→CH2=CHCl、nCH2=CHCl催化剂
本题解析:
本题难度:一般
4、简答题 七水硫酸镁(MgSO4?7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁.硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2
pH值
5.2
3.2
9.7
10.4
11.2
|
表2?两种盐的溶解度(单位为g/100g水)
| 温度/℃ | 10 | 30 | 40 | 50 | 60
CaSO4
0.19
0.21
0.21
0.20
0.19
MgSO4?7H2O
30.9
35.5
40.8
45.6
/
|
硼镁泥制取七水硫酸镁的工艺流程如下:
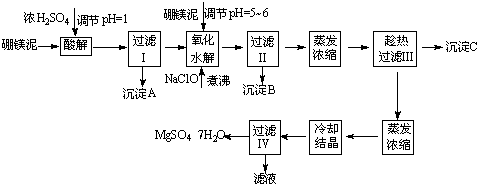
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为______.加热煮沸的主要目的是______.
(2)沉淀B中除MnO2、SiO2外还含有______(填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是______;
(4)沉淀C的化学式是______.过滤Ⅲ需趁热过滤的理由是______.
参考答案:(1)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解
以及Mn2+氧化成MnO2,故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;促进Al3+、Fe3+水解及Mn2+氧化成MnO2;
(2)根据表中数据可知,在调节溶液的PH在5~6时,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)3;
(3)Fe3+离子与KSCN溶液生成血红色的Fe(SCN)3,可利用该反应进行检验,故答案为:取过滤II后的滤液1~2?ml于试管中,加入少量KSCN溶液,如果溶液不显红色,
证明滤液中无Fe3+;
(4)CaSO4的溶解度随温度的变化不大,而MgSO4在温度较高时易溶于水,趁热过滤利于分离硫酸钙和硫酸镁,并防止MgSO4在温度低时结晶析出,
故答案为:CaSO4?2H2O或CaSO4;以防MgSO4在温度低时结晶析出.
本题解析:
本题难度:一般
5、选择题 下列各组离子反应能用H+ + OH- =H2O 表示的是
[? ]
A. NaOH溶液与CO2的反应
B. Ba(OH)2溶液和稀H2SO4的反应
C. NaOH溶液和盐酸的反应
D. 氨水和稀H2SO4的反应
参考答案:C
本题解析:
本题难度:简单
|