1、选择题 下列叙述中正确的是( )
A.在同一电子层上运动的电子,其自旋方向肯定不同
B.电子层序数越大,s原子轨道的形状相同,半径越大
C.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
D.原子最外层电子排布是5s1的元素,其氢氧化物不能使氢氧化铝溶解
参考答案:B
本题解析:
本题难度:简单
2、简答题 可正确表示原子轨道的是( )
A.2s
B.2d
C.3pz
D.3f
参考答案:A、2s能级只有1个轨道,故2s可以表示原子轨道,故A正确;
B、2d能级含有5个轨道,仅用能级符号2d,不能明确是哪一个轨道,故B错误;
C、3s能级含有3个轨道,3个轨道相互垂直,3pz表示为z轴上的轨道,故C正确;
D、3f能级含有7个轨道,仅用能级符号3f,不能明确是哪一个轨道,故d错误;
故选AC.
本题解析:
本题难度:一般
3、选择题 有Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则下列分析中不正确的是( )
A.粒子半径大小的关系是Xn->Yn+、X<Y
B.Z是稀有气体原子
C.原子核电荷数:Z>Y>X
D.Xn-、Yn+、Z的核外电子数相同
参考答案:Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,最外层电子数为8,X与Z同周期,Y在它们的下一周期,三种粒子其原子序数关系应为:Y>Z>X,核外电子排布相同,原子序数越小的离子半径越大.
A、具有相同电子层结构的离子,核电荷数越大,离子半径越小,阳离子Yn+的半径应小于阴离子Xn-,X与Z同周期,Y在它们的下一周期,原子半径Y>X,故A正确;
B、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,最外层电子数为8,Z一定是稀有气体元素,故B正确;
C、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,原子核电荷数:Y>Z>X,故C错误;
D、Xn-、Yn+、Z三种粒子,其核外电子层结构相同,则核外电子数相同,故D正确.
故选C.
本题解析:
本题难度:一般
4、简答题 (物质结构)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.请根据上表回答下列问题:
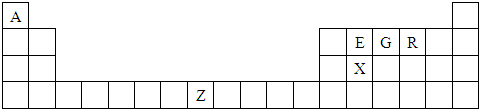
(1)G元素基态原子的电子排布式为______,其气态氢化物易液化,其原因是______.
(2)XR2中,X原子的轨道杂化类型为______,化合物ER2的熔点较XR2低,其原因是______.
(3)E、G、R三种元素的第一电离能由大到小的顺序是______(用元素符号填空).
(4)由A、E、G、R四种元素所形成的微粒中互为等电子体的有多组,请写出其中两组的化学式______.
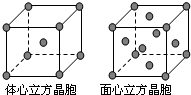
(5)单质Z的晶体在1183K以下时为体心立方堆积,在1183K以上时为面心立方堆积,其晶胞结构如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Z原子的个数之比为______.Z3+比Z2+更稳定一些,其原因可能是______.
参考答案:由元素在周期表中的位置可知,A为H,E为C,G为N,R为O,X为Si,Z为Fe,
(1)N的质子数为7,其电子排布式为1s22s22p3,因氨分子之间有氢键,则沸点高,易液化,故答案为:1s22s22p3;氨分子之间有氢键;
(2)SiO2中Si能形成4个Si-O键,则Si原子采取sp3杂化,又CO2属于分子晶体,SiO2属于原子晶体,则SiO2的熔点高,
故答案为:sp3;CO2属于分子晶体,SiO2属于原子晶体;
(3)非金属性越强,C的非金属性最弱,则C的第一电离能越大,但N原子的p轨道半满更稳定,失电子较难,则N的第一电离能最大,则
第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(4)因CH4和NH4+、NH3和H3O+、CO2和N2O、CO和N2中原子数目相同、价电子数相同,则它们属于等电子体,故答案为:CH4和NH4+、NH3和H3O+;
(5)体心立方晶胞中Fe原子在顶点和体心,则原子个数为1+8×18=2,面心立方晶胞中Fe原子在顶点和面心,原子个数为8×18+6×12=4,
则实际含有的Z原子的个数之比为2:4=1:2;又因Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态,则Fe3+比Fe2+更稳定一些,
故答案为:1:2;Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
本题解析:
本题难度:一般
5、填空题 (选修三)【物质结构与性质】
(1)氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。写出铬元素的基态原子核外电子排布式:_________________;与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有_______(填名称);CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是______(填“极性”或“非极性”)分子。
(2)在①苯、②CH3OH、③HCHO、④H2S四种分子中,属于非极性分子的是___________,分子间能形成氢键的是___________(以上两空填序号);H2S分子的空间构型是_______,HCHO分子中σ键与π键的个数比是____________。
(3)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。 A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如表所示:

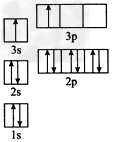
①某同学根据上述信息,推断B元素基态原子的核外电子排布如图所示,该同学所画的电子排布图违背了________________,
②根据等电子原理,推测A和氟元素形成的简单分子的等电子体有_______ (任写一个);
③根据对角线规则,A的化学性质与_____ 元素相似;试写出A与氢氧化钠溶液反应的离子方程式:_______________。
参考答案:(1)1s22s22p63s23p63d54s1{或[Ar]3d54s1};钾、铜;非极性
(2)①;②;角形(或V形或折线形);3:1
(3)①能量最低原理;②CO2、N2O、N3-;③Al(或铝);Be+2OH-=BeO22-+H2↑
本题解析:
本题难度:一般