| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》试题强化练习(2019年最新版)(二)
参考答案:C 本题解析: NH4Cl、NH4NO3都是一元强酸形成的铵盐,存在NH4+的水解作用,当盐的浓度相等时,二者的水解程度相同,所以NH4+离子的浓度相同,而NH4HCO3是弱酸弱碱盐,阳离子、阴离子都发生水解反应,水解相互促进,是铵根离子水解程度比只有铵根离子的水解程度大,所以NH4+离子的浓度小于NH4Cl;NH4HSO4是二元强酸的酸式盐,电离产生的H+会抑制铵根的水解作用,使铵根离子的水解作用小于NH4Cl,所以等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是NH4HSO4,选项是C。 本题难度:一般 2、选择题 常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是( ) |
参考答案:D
本题解析:若a=b,则溶质为醋酸钾,c(K+)>c(CH3COO-),c(OH-)>c(H+);
若a>b,则溶质为醋酸和醋酸钾,溶液可能呈酸性,c(OH-)<c(H+),c(K+)<c(CH3COO-);也可能呈中性,c(OH-)=c(H+),c(K+)=c(CH3COO-);也可能呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-);
若a<b,则溶质为醋酸钾和氢氧化钾,溶质呈碱性,c(OH-)>c(H+),c(K+)>c(CH3COO-)。
考点:酸碱中和
点评:分类讨论思想的应用。
本题难度:困难
3、选择题 下列物质中,水解的最终产物不能发生银镜反应的是( ? )
A.蔗糖
B.油脂
C.纤维素
D.淀粉
参考答案:B
本题解析:
本题难度:简单
4、选择题 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg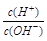 ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是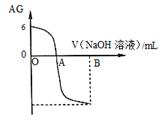
A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol/L的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-)
参考答案:AC
本题解析:A、根据图像可知A点AG=0,则c(H+) = c(OH-),即溶液显中性。由于醋酸钠水解显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,A错误;B、开始是AG=6,则根据AG=lg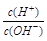 并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。
并依据水的离子积常数可知溶液中c(H+)=10-4mol/L,则pH=4,B正确;B、根据A中分析可知OA段醋酸过量溶液显酸性,但如果加入的氢氧化钠很少,则c(CH3COO-)<c(CH3COOH),C错误;D、若B点时加入NaOH溶液40 mL,则此时溶液是等物质的量浓度的醋酸钠和氢氧化钠的混合液,因此根据物料守恒c(CH3COO-)+c(CH3COOH)=2 c(Na+)和电荷守恒c(CH3COO-)+ c(OH-)=c(Na+) + c(H+) 可知所得溶液中:c(CH3COO-)+2c(CH3COOH) + c(H+)=c(OH-),D正确,答案选AC。
考点:考查酸碱中和滴定图像分析以及离子浓度大小比较
本题难度:一般
5、填空题 (共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 | OH- Cl- CO32- SO42- HSO4- |
参考答案:(1)Na2CO3、Al2(SO4)3、MgCl2、Ba(OH)2、NaHSO4[或Mg(HSO4)2]
(2)2Al3++3SO42- +3Ba2+ +8OH-=== 3BaSO4↓+2AlO2- +4H2O
(3)c( Na+)> c(CO32-)>c( OH-) >c(HCO3-)>c( H+)
本题解析:阴离子CO32-只能和Na+结合为Na2CO3;OH-能和Ba2+结合为溶于水的Ba(OH)2,则SO42-和Al3+结合成的物质为Al2(SO4)3;最后剩余Cl-和HSO4-结合的阳离子Na+、Mg2+;由题干可知A和B、C、D都生成沉淀且沉淀都溶于酸溶液,所以A为Na2CO3;E中含HSO4-,沉淀可以是Mg2+、Al3+、Ba2+的碳酸盐沉淀;B、C、D物质中分别含这三种阳离子,由④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3,可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4) 2),(1)综上所述,A为Na2CO3,B为Al2(SO4)3,C为MgCl2,D为Ba(OH)2,E为NaHSO4[或Mg(HSO4)2];(2)④中反应的离子方程式为2Al3++3SO42- +3Ba2+ +8OH-=== 3BaSO4↓+2AlO2- +4H2O;(3)A为碳酸钠,碳酸根离子水解显碱性,第一步水解大于第二步水解,则离子浓度大小为c( Na+)> c(CO32-)>c( OH-) >c(HCO3-)>c( H+)。
考点:考查无机物的推断。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《化学反应速.. | |