1、实验题 过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:?
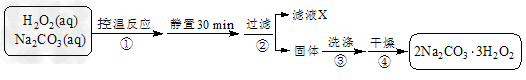
已知:主反应2Na2CO3?(aq)?+?3H2O2?(aq) 2Na2CO3·3H2O2?(s)?ΔH?<?0
2Na2CO3·3H2O2?(s)?ΔH?<?0
副反应?2H2O2?=?2H2O?+?O2↑
滴定反应?6KMnO4?+?5(2Na2CO3·3H2O2)?+19H2SO4?=3K2SO4?+?6MnSO4?+10Na2SO4?+?10CO2?↑?+?15O2↑?+?34H2O
50?°C时,2Na2CO3·3H2O2?(s)?开始分解
请回答下列问题:
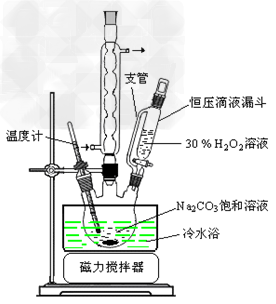
(1)图中支管的作用是___________。
(2)步骤①的关键是控制温度,其措施有__________、____________和___________。
(3)在滤液X中加入适量NaCl固体或无水乙醇,? 均可析出过碳酸钠,原因是__________。
(4)步骤③中选用无水乙醇洗涤产品的目的是____________。
(5)下列物质中,会引起过碳酸钠分解的有____________。
A.Fe2O3 B.CuO C.Na2SiO3 D.MgSO4
(6)准确称取0.2000?g?过碳酸钠于250?mL?锥形瓶中,加50?mL?蒸馏水溶解,再加50?mL?2.0?mol·L-1?H2SO4,用2.000×10-2?mol·L-1?KMnO4?标准溶液滴定至终点时消耗30.00?mL,则产品中H2O2的质量分数为_____________。
参考答案:(1)平衡压强
(2)冷水浴?;?磁力搅拌?;?缓慢滴加H2O2溶液
(3)降低产品的溶解度(盐析作用或醇析作用)
(4)洗去水份,利于干燥
(5)AB
(6)25.50 %?(或0.2550 )
本题解析:
本题难度:一般
2、实验题 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备;其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3 mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题
(1)在步骤1的操作中,下列仪器中不必用到的有_________(填仪器编号);
①铁架台②燃烧匙③锥形瓶④广口瓶⑤研钵⑥玻璃棒⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是____________________;
(3)在步骤3中,“一系列操作”依次为_______、_______和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是_____________,可以观察到的现象是_______________。
参考答案:(1)②④⑤
(2)抑制亚铁离子的水解
(3)酸化蒸发;结晶
(4)KSCN溶液;溶液出现血红色
本题解析:
本题难度:一般
3、选择题 下列说法错误的是
[?]
A.蔗糖、硫酸钡和碳酸分别属于非电解质、强电解质和弱电解质?
B.将FeCl3固体溶解于沸水中可制得Fe(OH)3胶体 ?
C.常温常压下,28g?N2和CO的混合气体中,原子总数一定是2NA?
D.硫酸、熟石灰、纯碱和生石灰分别属于酸、碱、盐和氧化物
参考答案:B
本题解析:
本题难度:简单
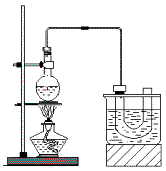
4、实验题 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
回答下列问题
(1)该实验制取溴乙烷的化学方程式为:_______________。
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为___________,同时生成的无色气体分子式为_______________。
(3)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是__________。
(4)U型管内可观察到的现象是_____________________________。
(5)反应结束后,U形管中粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的
_________________(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行_______________(填操作名称)。
(6)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后
__________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
参考答案:(1)C2H5OH+NaBr+H2SO4 NaHSO4+C2H5Br+H2O?
NaHSO4+C2H5Br+H2O?
(2)Br2;SO2和H2O
(3)水浴加热?
(4)有油状液体生成
(5)c;分液漏斗;蒸馏
(6)④①⑤③②
本题解析:
本题难度:困难
5、填空题 已知下表数据:

某学生做乙酸乙酯的制备实验
(1)写出该反应的方程式_________________________。
(2)按装置图安装好仪器后,在大试管中配制好体积比为3:2的乙醇和乙酸,加热至沸腾,很久也没有果香味液体生成,原因是_______________________。
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是________________。
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。

(4)写出加入的试剂试剂(a)是______;试剂(b)是______。
(5)写出有关的操作分离方法 ①是_____,②是_____,③是_____。
(6)在得到的A中加入无水碳酸钠粉末,振荡,目的是__________________。
参考答案:
(1)CH3CH2OH+CH3COOH CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)漏加浓硫酸
(3)乙醇的沸点比乙酸较低,易挥发而损耗
(4)饱和碳酸钠溶液;稀硫酸
(5)分液;蒸馏;蒸馏
(6)除去乙酸乙酯中混有的少量水
本题解析:
本题难度:一般