1、选择题 使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平称量时游码没有归零
②用量筒量取液体时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①②⑤
B.①③⑥
C.③④⑥
D.①②④
参考答案:B
本题解析:
本题难度:简单
2、填空题 (12分) 有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子:(每种物质只含一种阳离子和一种阴离子且互不重复)
阳离子
| Na+、Ba2+、NH4+、K+
|
阴离子
| CH3COO-、Cl-、OH-、SO42-
|
?
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是____________。
(2)用离子方程式表示A的水溶液显碱性的原因______________________________。
(3)25 ℃时pH=9的A溶液和pH=9的C溶液中水的电离程度较小的是________(填写A或C的化学式)。
(4)25 ℃时用惰性电极电解D的水溶液,一段时间后溶液的pH________7(填“>”、“<”或“=”)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________________________________________________。
(6)室温时在一定体积0.2 mol·L-1的C溶液中,加入一定体积的0.1 mol·L-1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是________。
参考答案:(12分)(1)醋酸钾?(2)CH3COO-+H2O CH3COOH+OH- (3)Ba(OH)2? (4)=
CH3COOH+OH- (3)Ba(OH)2? (4)=
(5)c(OH-)>c(Ba2+)=c(Cl-)>c(NH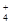 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH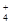 )>c(H+) (6)2∶3
)>c(H+) (6)2∶3
本题解析:(1)D溶液焰色反应显黄色,说明含有Na+。C溶液和D溶液相遇时只生成白色沉淀,则白色沉淀是硫酸钡,因此D是硫酸钠。B溶液和C溶液相遇时只生成有刺激性气味的气体,则该气体是氨气。又因为A、C溶液的pH均大于7,B溶液的pH小于7,所以B是氯化铵,则C氢氧化钡,A就是醋酸钾。
(2)醋酸钾是强酸弱碱盐,水解显碱性,即CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(3)醋酸钾水解促进水的电离,氢氧化钡是强碱,抑制水的电离,所以溶液中水的电离程度较小的是Ba(OH)2。
(4)惰性电极电解硫酸钠溶液,则实质是电解水,溶液始终显中性,即pH=7。
(5)等体积、等物质的量浓度的B溶液和C溶液混合后,氢氧化钡过量,因此反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH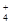 )>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH
)>c(H+)或c(OH-)>c(Cl-)=c(Ba2+)>c(NH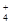 )>c(H+)。
)>c(H+)。
(6)混合溶液的pH=13,即OH-的浓度是0.1mol/L。这说明氢氧化钡是过量的,则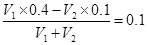 ,解得
,解得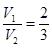 。
。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,难易适中、注重考查学生分析问题、以及灵活运用基础知识解决问题的能力。有助于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率。
本题难度:一般
3、选择题 下列除去括号内杂质的有关操作方法不正确的是
A.淀粉溶液(葡萄糖):渗析
B.甲苯(苯酚):加浓溴水,过滤
C.甲醇溶液(甲酸):加NaOH溶液,蒸馏
D.肥皂液(甘油):加食盐搅拌、盐析、过滤
参考答案:B
本题解析:甲苯(苯酚)加浓溴水并不能生成沉淀,一般是加入碱液,再分流蒸馏。
本题难度:一般
4、选择题 下列物质除杂(括号内物质为杂质)的方法及试剂都正确的是?
[? ]
物质?
方法
?试剂
A.
CO2(SO2)
洗气
氢氧化钠溶液
B.
AlCl3(MgCl2)?
过滤
氢氧化钠溶液
C.
水(乙醇)?
萃取、分液
乙酸
D.
Fe(Al)?
过滤
过量氢氧化钠溶液
参考答案:D
本题解析:
本题难度:一般
5、实验题 乙酰水杨酸俗称阿司匹林(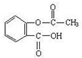 ),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
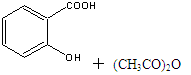


制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
名称
| 相对分子质量
| 熔点或沸点(℃)
| 水
|
水杨酸
| 138
| 158(熔点)
| 微溶
|
醋酸酐
| 102
| 139.4(沸点)
| 反应
|
乙酰水杨酸
| 180
| 135(熔点)
| 微溶
|
?
回答下列问题:
(1)合成阿司匹林时,最合适的加热方法是?。
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是?。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是?。
(4)用重结晶方法提纯粗产品流程如下,加热回流程装置如图。


①沸石的作用是?;
②冷凝水的流进方向是?(填“a”或“b”);
③使用温度计的目的是?。
(5)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(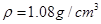 ),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为?(百分数精确到0.1)。
),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为?(百分数精确到0.1)。
参考答案:(1)水浴加热(2分)
(2)防止醋酸酐和水反应(2分)
(3)除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗(2分)
(4)①防止暴沸(2分)②a(2分)③便于调控加热温度,防止乙酰水杨酸分解(2分)
(4)84.3%(或84.6%)(2分)
本题解析:(1)控制温度在85℃~90℃,小于100℃,应使用水浴加热;
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是乙酸酐容易发生水解,所以答案是防止醋酸酐和水反应;
(3)洗涤晶体,除去表面的杂质,用冷水,目的是减小阿司匹林的溶解,所以答案是除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗;
(4)①沸石的作用是防止暴沸;
②为使冷凝管内的不蒸气得到充分冷却,在进行冷却时,应使水的方向和气流的方向相反,使水充满整个冷凝管,所以冷凝水的流进方向是a;
③使用温度计的目的是便于调控加热温度,防止乙酰水杨酸分解;
(4))(水杨酸)=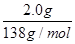 =0.0145mol,n(醋酸酐)=
=0.0145mol,n(醋酸酐)= =0.053mol,
=0.053mol,
则理论上生成乙酰水杨酸0.0145mol,产率为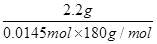 ?×100%=84.3%。
?×100%=84.3%。
本题难度:一般