1、选择题 在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3,搅拌后静置,最终所得晶体的质量
A.等于1.06克
B.大于1.06克而小于2.86克
C.等于2.86克
D.大于2.86克
参考答案:D
本题解析:分析:从两个角度来分析:(1)无水Na2CO3与水反应生成结晶水合物Na2CO3?10H2O;
(2)原饱和溶液由于加入无水Na2CO3与水反应而消耗溶液中的水,会有晶体析出.
解答:1.06克无水Na2CO3的物质的量为0.01mol,加入到饱和Na2CO3溶液中生成0.01molNa2CO3?10H2O结晶水合物,其质量为0.01mol×286g/mol=2.86g,
又原饱和溶液由于加入无水Na2CO3与水反应而消耗溶液中的水,会有晶体析出,故析出晶体的质量大于2.86g.
故选D.
点评:本题考查饱和溶液的计算问题,本题难度不大,做题时注意析出晶体后剩余溶液仍为饱和溶液,特别是形成结晶水合物这一点.
本题难度:困难
2、选择题 下列除杂质的操作中不正确的是( )
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤
B.CO2中混有HCl:将其通入NaOH溶液
C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体
D.NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液
参考答案:A.金属Al既能与酸反应又能与碱反应,而铁不溶于碱,故可用来分离该两种金属,故A正确;
B.NaOH溶液能与二氧化碳和HCl反应,将原物质除掉,故B错误;
C.除去NaHCO3溶液中含有的Na2CO3溶质可在溶液中通入过量二氧化碳气体,Na2CO3溶液可与二氧化碳反应生成NaHCO3,故C正确;
D.碘单质易溶于四氯化碳,四氯化碳与水互不相溶,故D正确.
故选B.
本题解析:
本题难度:一般
3、实验题 海带成分中碘的检验实验方案设计。
(1)干海带灼烧后,将海带灰放至小烧杯中加入适量蒸馏水,搅拌、煮沸冷却、过滤。将滤液分成四份放入四支试管中,并标为1、2、3、4号。
(2)在1号试管中滴入6滴稀硫酸后,再加入约3 mL H2O2溶液,滴入1%淀粉液1~2滴,观察到溶液立刻由褐色变成蓝色,离子方程式为 。?
(3)在2号试管中加入2 mL新制的饱和氯水,振荡溶液,观察现象,离子反应方程式为 。2 min后把加入氯水的溶液分成两份。其中甲中再滴入1%淀粉液1~2滴,观察现象为 ,乙溶液中加入2 mL CCl4,振荡萃取,静置2 min后观察现象为 。?
(4)在3号试管中加入食用碘盐3 g,振荡使之充分溶解后滴入6滴稀硫酸。在滴入1%淀粉液1~2滴,观察到溶液立刻由无色变成蓝色,相关的离子方程式为 。?
(5)在4号试管中加入硝酸银溶液,振荡,再加入稀硝酸溶液。原想利用反应生成黄色沉淀来检验碘离子。通过实验发现生成白色沉淀。用此方法检验碘元素失败。导致此步失败的可能原因是 。?
参考答案:(2)2I-+2H++H2O2 I2+2H2O (3)2I-+Cl2
I2+2H2O (3)2I-+Cl2 I2+2Cl- 溶液变蓝 液体分层,下层紫红色 (4)5I-+I
I2+2Cl- 溶液变蓝 液体分层,下层紫红色 (4)5I-+I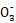 +6H+
+6H+ 3I2+3H2O (5)因为海带中附着着大量的NaCl,使溶液中的Cl-浓度比I-浓度大得多,所以生成AgCl沉淀
3I2+3H2O (5)因为海带中附着着大量的NaCl,使溶液中的Cl-浓度比I-浓度大得多,所以生成AgCl沉淀
本题解析:(4)由信息可知I-被氧化生成I2,食盐中的氧化剂只能是KIO3;⑤海水中含量最多的盐是NaCl
本题难度:一般
4、填空题 某同学用废于电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
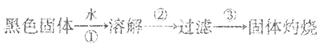
(1)上述三步操作中都用到的一种玻璃仪器是_____________________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使带火星的木条复燃的气体,由此推断黑色固体中含有MnO2,其在反应中的作用为________,写出该反应的化学方程式_______________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式_____________________________________。
(3)验证步骤②的滤液中含有NH4+,下面是某一实验方案记录片断。请填写下列空白:
实验操作:_______________________________________________________________。
实验现象:有使湿润的红色石蕊试纸变蓝的气体产生。
实验结论:滤液中有NH4+存在。
参考答案:(1)玻璃棒(1分)
(2)催化剂(1分)? 2H2O2 2H2O+O2(2分)
2H2O+O2(2分)
MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(3)取②得适量滤液于试管中,加入氢氧化钠的浓溶液,加热,将湿润的红色石蕊试纸放在试管口观察现象。(2分)
本题解析:(1)溶解,过滤,灼烧都用到的玻璃仪器是玻璃棒。(2)MnO2可以作为双氧水分解的催化剂。
MnO2作氧化剂的常见反应就是实验室制氯气的反应。2的性质和铵根的检验。
本题难度:一般
5、填空题 (10分)按下列要求回答
(1)除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
①Fe(Al)??②NH3(H2O)?
③NO(NO2)??④NaCl溶液(Na2SO4)?
(2)实验室配制100mL0.5mol·L?1的Na2CO3溶液,回答下列问题:
①应用托盘天平称取碳酸钠粉末?g。
②配制时应选用的仪器有500mL溶量瓶,托盘天平、烧杯、药匙、?。
③若实验时遇到下列情况,所配溶液的浓度偏大的是?。
A.加水定容时超过刻度线,又吸出少量至刻度线
B.没有将洗涤液转入容量瓶
C.容量瓶洗涤后内壁有水珠而未作干燥 处理
处理
D.定容时府视刻度线
参考答案:(1) NaOH?碱石灰? H2O? BaCl2(适量)?各1分
(2) 5.3g?玻璃棒、胶头滴管? D?各2分
本题解析:略
本题难度:简单