1、填空题 (1)写出下列物质在水中的电离方程式:①CuCl2______②NaHCO3______③KHSO4______
(2)按要求写出下列反应的离子方程式①氢氧化铜溶于盐酸______②硫酸镁溶液中滴加氢氧化钡溶液______
(3)写出与离子反应方程式CO2+2OH-=CO32-+H2O所对应的其中一个化学方程式______.
参考答案:(1)这几种物质都是强电解质,在水溶液里完全电离生成阴阳离子,
①氯化铜的电离方程式为:CuCl2=Cu2++2Cl-,故答案为:CuCl2=Cu2++2Cl-;
②碳酸氢钠的电离方程式为:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
③硫酸氢钠的电离方程式为:KHSO4=K++H++SO42-,故答案为:KHSO4=K++H++SO42-;
(2)①氢氧化铜和稀盐酸反应生成氯化铜和水,离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
②硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡,离子方程式为Mg2++2OH-+Ba2++SO42-=BaSO4↓+Mg(OH)2↓,故答案为:Mg2++2OH-+Ba2++SO42-=BaSO4↓+Mg(OH)2↓;
(3)该方程式为二氧化碳和强碱反应生成可溶性碳酸盐和水,反应方程式为:CO2+2NaOH=Na2CO3+H2O,故答案为:CO2+2NaOH=Na2CO3+H2O.
本题解析:
本题难度:一般
2、选择题 不能用H++OH-=H2O表示的反应是(?)
A.盐酸与氢氧化钾溶液反应
B.稀硫酸与氢氧化钡溶液反应
C.稀硝酸与氢氧化钠溶液反应
D.硫酸与氢氧化钠溶液反应
参考答案:B
本题解析:略
本题难度:一般
3、简答题 往100ml?1mol?L的Al2(SO4)3?溶液中加入100ml?4mol?L?Ba(OH)2溶液,最终得到沉淀的质量是( )
A.15.6g
B.69.9g
C.93.2g
D.85.5g
参考答案:Al2(SO4)3?溶液中:n(Al3+)=0.1L×1mol/L×2=0.2mol,n(SO42-)=0.1L×1mol/L×3=0.3mol,
Ba(OH)2溶液中:n(Ba2+)=0.1L×4mol/L×1=0.4mol,n(OH-)=0.1L×4mol/L×2=0.8mol,
由Ba2++SO42-=BaSO4↓可知,0.3molSO42-反应需要0.3molBa2+,Ba2+有剩余,0.3molSO42-完全反应,生成BaSO4为0.3mol;
由Al3++3OH-=Al(OH)3↓可知,0.2molAl3+完全反应生成Al(OH)3,需要0.6molOH-,剩余OH-为0.8mol-0.6mol=0.2mol,生成Al(OH)3为0.2mol,由Al(OH)3+OH-=AlO2-+2H2O可知,生成的0.2molAl(OH)3与剩余的0.2molOH-恰好反应,故最终固体为BaSO4为0.3mol,质量为0.3mol×233g/mol=69.9g;
故选B.
本题解析:
本题难度:一般
4、选择题 下列离子方程式中正确的是( )
A.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
B.次氯酸钙溶液中通入少量二氧化硫:2ClO-+SO2+H2O=2HClO+SO32-
C.BaCl2溶液中通入少量CO2:Ba2++CO2+H2O=BaCO3↓+2H+
D.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
参考答案:A.NH4HCO3溶液与过量NaOH溶液反应的离子反应为HCO3-+NH4++2OH-=NH3.H2O+H2O+CO32-,故A错误;
B.次氯酸钙溶液中通入少量二氧化硫的离子反应为Ca2++ClO-+SO2+H2O=2H++Cl-+CaSO4,故B错误;
C.BaCl2溶液中通入少量CO2不反应,不能写离子反应,故C错误;
D.过量的NaHSO4与Ba(OH)2溶液反应的离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2====Fe3++2Cl-
B.Ba(OH)2溶液与硫酸的反应:OH-+H+====H2O
C.偏铝酸钠溶液中滴加过量盐酸: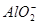 +4H+====Al3++2H2O
+4H+====Al3++2H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-====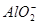 +2H2O
+2H2O
参考答案:C
本题解析:A不正确,电子的得失不守恒;B不正确,还有硫酸钡产生;D不正确,氢氧化铝不能溶于氨水中,所以正确的答案选C。
本题难度:简单