1、选择题 将一定量的SO2通入Ca(ClO)2溶液中,下列反应的离子方程式一定错误的是
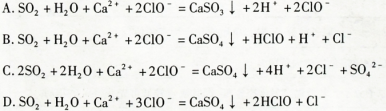
参考答案:A
本题解析: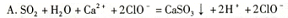 SO2有还原性,ClO-有氧化性,二者会发生氧化还原反应,ClO-把生成的CaSO3氧化为CaSO4,它本身被还原为Cl-。因此错误的选项为A。其它的选项中由于二者相对量的多少不同,产物不同,离子方程式也不同,但都符合客观事实,符合质量守恒定律及电荷守恒。
SO2有还原性,ClO-有氧化性,二者会发生氧化还原反应,ClO-把生成的CaSO3氧化为CaSO4,它本身被还原为Cl-。因此错误的选项为A。其它的选项中由于二者相对量的多少不同,产物不同,离子方程式也不同,但都符合客观事实,符合质量守恒定律及电荷守恒。
本题难度:一般
2、选择题 下列离子方程正确的是( )
A.氯气与水反应:Cl2+H2O═2H++Cl-+ClO-
B.把盐酸滴在石灰石上:CaCO3+2H+═Ca2++H2O+CO2↑
C.氯气与氯化亚铁溶液反应:Cl2+Fe2+═2Cl-+Fe3+
D.澄清石灰水与过量碳酸氢钠溶液反应:Ca2++OH─+HCO3-═CaCO3↓+H2O
参考答案:A.氯气与水反应是可逆反应,生成的次氯酸是弱电解质,应写化学式,正确的离子方程式为Cl2+H2O?H++Cl-+HClO,故A错误;
B.石灰石的成分为碳酸钙,盐酸酸性强于碳酸,碳酸钙可以和盐酸反应CaCO3+2HCl=CaCl2+H2O+CO2↑,碳酸钙、二氧化碳和水应写化学式,离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故B正确;
C.氯气与氯化亚铁溶液反应生成氯化铁,离子反应为2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D.Ca(OH)2溶液中电离出Ca2+与OH-,NaHCO3溶液中电离出Na+与HCO3-,OH-与HCO3-可以反应生成CO32-与H2O,生成的CO32-又可以与Ca2+生成CaCO3↓,此反应产物与药品用量有关:若Ca(OH)2过量,Ca(OH)2+NaHCO3═CaCO3↓+H2O+NaOH,若NaHCO3过量,Ca(OH)2+2NaHCO3═CaCO3↓+2H2O+Na2CO3,由于本选项是碳酸氢钠过量,反应的离子方程式为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故D错误;
故选B.
本题解析:
本题难度:一般
3、选择题 下列表示对应化学反应的离子方程式正确的是( )
A.硫化钠的水解反应:S2—+2H2O H2S+2OH-
H2S+2OH-
B.硫酸亚铁溶液中滴加酸化的双氧水:2Fe2++2H++H2O2 2Fe3++2H2O
2Fe3++2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO32—+OH- CO32—+H2O
CO32—+H2O
D.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH- Na2SiO3↓+H2O
Na2SiO3↓+H2O
参考答案:B
本题解析:多元弱酸根离子分步水解,以第一步水解为主,生成HS-,A错;C选项应生成碳酸钙沉淀;D选项中硅酸钠为可溶性盐,要拆写成离子的形式。
本题难度:一般
4、简答题 (1)0.5molO3中含有的分子数是______个,原子数是______个,质子数是______个.
(2)将4gNaOH溶于______克水中,才能使每100个H2O分子溶有一个Na+.
(3)将下列残缺的离子方程式补充完整,然后写出一个相应的化学方程式.
Cu(OH)2+______=Cu2++______
(4)下列物质能导电的是______,属于电解质的是______,属于非电解质的是______.
①水银?②烧碱?③干冰?④氯化钠晶体?⑤盐酸溶液?⑥蔗糖
(5)在标准状况下,1.7g氨气所占的体积为______L,它与标准状况下______L的硫化氢(H2S)含有相同数目的氢原子.
参考答案:(1)0.5molO3中含有的分子数为0.5mol×NA=0.5NA,原子数为0.5mol×3×NA=1.5NA,
质子数为0.5mol×8×3×NA=12NA,
故答案为:0.5NA;1.5NA;12NA;
(2)NaOH的物质的量为4g40g/mol=0.1mol,设水的物质的量为x,由每100个H2O分子溶有一个Na+,则
1001=x0.1mol,解得x=10mol,
则水的质量为10mol×18g/mol=180g,故答案为:180;
(3)氢氧化铜能溶于酸,如Cu(OH)2+2HCl=CuCl2+2H2O,其离子反应为Cu(OH)2+2H+=Cu2++2H2O,
故答案为:2H+;2H2O;Cu(OH)2+2HCl=CuCl2+2H2O;
(4)①水银为金属,存在自由移动的电子,能导电,⑤盐酸溶液中存在自由移动的离子,能导电,即能导电的是①⑤;②烧碱、④氯化钠晶体都符合在水中或熔化状态下能导电的化合物,则②④是电解质;③干冰在熔融状态下不导电,在溶液中能导电是由于与水反应生成碳酸,但本身不能电离出自由移动的离子,属于非电解质,⑥蔗糖符合在水中和熔化状态下都不能导电的化合物,则③⑥属于非电解质,故答案为:①⑤;②④;③⑥;
(5)氨气的物质的量为1.7g17g/mol=0.1mol,标准状况下Vm=22.4L/mol,则其体积为0.1mol×22.4L/mol=2.24L,
设硫化氢的体积为y,根据氢原子数目相同,则0.1mol×3=y22.4L/mol×2,解得y=3.36L,
故答案为:2.24;3.36.
本题解析:
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式是
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
参考答案:D
本题解析:A中生成亚铁离子;B中不能置换出铜,因钠与水反应;C中碳酸氢根离子要保留。答案选D。
本题难度:简单