1、简答题 化学-选修物质结构与性质:
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A的简单氢化物分子中其中心原子采取______杂化,E的最高价氧化物分子的空间构型是______.
(2)B的氯化物的熔点比D的氯化物的熔点______(填高或低),理由是______.
(3)A、B、C、D的第一电离能由小到大的顺序为______.(用元素符号表示)
(4)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为______;(每个球均表示1个原子)
(5)F的核外电子排布式是______,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为______.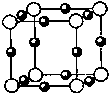
参考答案:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,A原子核外有三个未成对电子,则电子排布式为1s22s22p3,即A为N元素;C元素是地壳中含量最高的金属元素,则C为Al元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;化合物B2E的晶体为离子晶体,则B为第三周期第ⅠA族元素,即B为Na元素;D单质的晶体类型在同周期的单质中没有相同的,Si的晶体类型为原子晶体,与其它不同,则D为Si元素;F原子核外最外层电子数与B相同,其余各层电子均充满,其电子排布式为1s22s22p63s23p63d104s1,则F为K元素,
(1)氨气中N原子上有1对孤对电子,σ键数为3,则N原子采取sp3杂化,SO3中S原子采取sp2杂化,则空间构型为平面三角型,故答案为:sp3;平面三角型;
(2)B的氯化物为NaCl,为离子晶体,而D的氯化物为SiCl4,为分子晶体,离子晶体的熔点高于分子晶体的熔点,故答案为:高;NaCl为离子晶体而SiCl4为分子晶体;
(3)非金属性越强,第一电离能越大,金属性越强,第一电离能越小,则A、B、C、D的第一电离能由小到大的顺序为Na<Al<Si<N,故答案为:Na<Al<Si<N;
(4)F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×18=1,Cu原子在棱心,则Cu原子数为12×14=3,所以化学式为Cu3N,故答案为:Cu3N;
(5)Cu的电子排布式为1s22s22p63s23p63d104s1(或[Ar]3d104s1),A、C形成的化合物AlN,具有高沸点和高硬度,为原子晶体,
故答案为:1s22s22p63s23p63d104s1(或[Ar]3d104s1);AlN.
本题解析:
本题难度:一般
2、填空题 如图是磷的原子结构示意图,由此可知磷元素位于元素周期表中的第______周期,第______族.
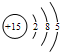
参考答案:磷的原子结构示意图为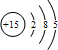 ,原子核外有3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族,
,原子核外有3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族,
故答案为:三;ⅤA.
本题解析:
本题难度:一般
3、选择题 aXn-和bYm+为两主族元素的离子,它们的电子层结构相同,下列判断错误的是( )
A.原子半径X<Y
B.a+n=b-m
C.Y最高价氧化物的化学式为YOm
D.X的氢化物的化学式为HnX
参考答案:aXn-和bYm+为两主族元素的离子,它们的电子层结构相同,即X和Y核外电子数相等,aXn-的核外电子数=a+n,bYm+的核外电子数=b-m,X和Y核外电子数相等,所以a+n=b-m,故a的原子序数小于b的原子序数,因为X、Y的离子一个是阴离子,一个是阳离子,所以Y位于X的下一周期.
A、Y位于X的下一周期,Y的半径大于同周期的X的同主族元素,x的半径小于下一周期同一主族元素的原子半径,所以原子半径X<Y,故A正确;
B、通过以上分析知,a+n=b-m,故B正确;
C、在Y的最高价氧化物中,Y的最高化合价为+m,氧元素的化合价为-2,根据化合物中各元素的化合价代数和为0,所以其化学式为Y2Om,故C错误;
D、X的氢化物中氢元素的化合价为+1价,X的化合价为-n,所以X的氢化物的化学式为HnX,故D正确;
故选C.
本题解析:
本题难度:一般
4、选择题 X、Y是周期表中的两种元素,X原子的半径比Y的半径小,且具有相同的电子层数,(选项中m、n均为正整数)下列有关叙述正确的是( )
A.若X、Y原子序数相差1,Y为ⅡA族,则X一定是ⅢA族
B.若HnXOm为强酸,则X的氢化物溶液于水一定显酸性
C.若Y元素形成的单质是气体,则X元素形成的单质一定也是气体
D.若Y(OH)m易溶于水,则X(OH)n一定不溶于水
参考答案:电子层数相等,x原子的半径比y的原子半径小,那么X的核电荷数必然比Y大,所以在周期表中,X的位置在Y的右边.
A 没说是短周期元素,X可能为第IIIB族,故A错误.
B 若X为N元素,氢化物为NH3,其水溶液显碱性,故B错误.
C 同一周期,单质的状态由固态到气态,或由固态到液态再到气态,X的位置在Y的右边,所以,若Y元素形成的单质是气体,则X元素形成的单质一定也是气体,故C正确.
D若Y为K元素,X为Ca? 氢氧化钙能溶于水,故D错误.
故选C.
本题解析:
本题难度:简单
5、填空题 已知A、B、C、D、E是短周期中的5种非金属元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零,C、D在元素周期表中处于相邻的位置,B原子的最外层电子数是内层电子数的2倍.E元素与D元素同主族;E的单质为黄色晶体,易溶于二硫化碳.
(1)请写出下列元素的元素符号?A:______C:______E:______
(2)画出E的阴离子结构示意图:______
(3)A的单质和C的单质在一定条件下生成化合物X,X的电子式为______;向X的水溶液中滴入酚酞溶液,会观察到______.
参考答案:(1)A元素原子形成的离子核外电子数为零,则A为H;B原子的最外层电子数是内层电子数的2倍,则B为C;
E的单质为黄色晶体,易溶于二硫化碳,则E为S;E元素与D元素同主族,则D为O;C、D在元素周期表中处于相邻的位置,有D的原子序数大,则C为N.故(1)答案为:H,N,S;
(2)S最外层有6个电子,形成离子时得到2个电子,故答案为:

(3)A的单质和C的单质在一定条件下生成化合物X,则X为NH3,电子式为
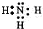
,氨溶于水显碱性,滴入酚酞变红
故答案为
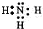
;溶液变红.
本题解析:
本题难度:一般