1、选择题 下列分子结构中,原子的最外电子都能满足8电子稳定结构的是(?)
A.XeF2
B.CO2
C.PCl5
D.HClO
参考答案:B
本题解析:在分子形成的过程中,原子都有趋向最外层电子层为8(或2)电子的“稳定结构”(稀有气体原子的结构)。离子化合物形成时,活泼的金属原子失去最外层的少数电子,形成稳定阳离子结构;活泼的非金属原子获得电子,最外层补足到8电子,形成稳定的阴离子结构。共价化合物形成时,原子间相互吸引对方的电子,组成共用电子对,形成8电子稳定结构。常见的稳定结构多为8电子结构,但也存在非电子结构的稳定状态。如对氢原子来说,最外层有2个电子,就达到稳定结构。
选项C的磷原子,最外层有5个电子,分别和5个氯原子结合,形成5个共用电子对,磷原子最外层形成10个电子结构。选项D中的次氯酸,含氧酸的结构是:+1价的氯原子和-1价的氢氧根原子团结合,也就是氧原子分别和氢原子、氯原子结合,氧原子达到8电子稳定结构,而氢原子仅能达到2电子的稳定结构。在选项A中,稀有气体氙原子的结构已是稳定结构,当它和氟原子结合时,最外层电子数必然超过8个。本题的正确选项只能是B,CO2的结构中,碳原子分别和两个氧原子形成碳氧双键,每个原子的最外层为8电子稳定结构。
本题难度:简单
2、填空题 (6分)写出下列原子的电子排布式。
(1)S (2)29Cu (3) 26Fe
(1)________________________________________________________________________
(2)________________________________________________________________________
(3)________________________________________________________________________
参考答案:(1)1s22s22p63s23p4?(2)1s22s22p63s23p63d104s1?(3)1s22s22p63s23p63d64s2
本题解析:根据构造原理、洪特规则以及保利不相容原理可知,S、Cu和Fe的核外电子排布式分别是1s22s22p63s23p4、1s22s22p63s23p63d104s1、1s22s22p63s23p63d64s2。
点评:该题是基础性试题的考查,难度不大,试题注重基础,主要是考查学生对核外电子排布的了解、掌握情况,特别是灵活运用构造原理书写排布式的熟悉程度,有利于培养学生的规范答题能力。
本题难度:一般
3、填空题 (本题共12分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3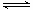 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压? b.增加NH3的浓度? c.升温? d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。
_________________________________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为____________________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
参考答案:(1)bc?(2)2NH3+CO2+H2O→(NH4)2CO3、(NH4)2CO3+CO2+H2O→2NH4HCO
(3)①低温加压下吸收CO;②然后将铜液洗涤转移至另一容器中;③高温低压下释放CO,然后将铜洗液循环利用。
(4)C>N>O>H;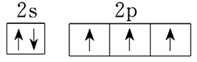 ;NH3和PH3的稳定性
;NH3和PH3的稳定性
(5)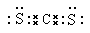 ;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
本题解析:(1)降低压强,反应速率减小,a不正确;增加NH3的浓度或升高温度,反应速率均增大bc正确;及时移走产物,即降低生成物浓度,反应速率也减小,d不正确,答案选bc。
(2)氨气是碱性气体,CO2是酸性气体,二者反应的化学方程式为2NH3+CO2+H2O→(NH4)2CO3、(NH4)2CO3+CO2+H2O→2NH4HCO3。
(3)根据Cu(NH3)2Ac+CO+NH3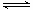 [Cu(NH3)3CO]Ac可知,该反应是体积减小的放热的可逆反应,因此吸收CO的适宜条件是低温加压下吸收CO。若要再生,则只需要将铜液洗涤转移至另一容器中;然后高温低压下释放CO,最后将铜洗液循环利用即可。
[Cu(NH3)3CO]Ac可知,该反应是体积减小的放热的可逆反应,因此吸收CO的适宜条件是低温加压下吸收CO。若要再生,则只需要将铜液洗涤转移至另一容器中;然后高温低压下释放CO,最后将铜洗液循环利用即可。
(4)铜液的组成元素中属于短周期元素的是H、C、N、O,同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则四种元素的原子半径大小顺序是C>N>O>H;氮元素原子最外层有4个电子,根据核外电子排布规律可知,最外层电子排布的轨道表达式是 。非金属性越强,氢化物的稳定性越强,因此可通过比较NH3和PH3的稳定性判断氮、磷两种非金属元素的非金属性强弱。
。非金属性越强,氢化物的稳定性越强,因此可通过比较NH3和PH3的稳定性判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,则根据CO2的电子式可得CS2的电子式是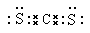 。CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大,因此CS2熔点高于CO2。
。CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大,因此CS2熔点高于CO2。
本题难度:一般
4、填空题 (本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  ?KCl (l)+NaAlSi3O8 (s)。
?KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了?个轨道,有?种能量。
(2)氯化钠的熔点比氯化钾的?(填“高”或“低”),原因是?。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列?。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是?。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
?时间(h)
钾元素
温度?熔出率
| 1.5
| 2.5
| 3.0
| 3.5
| 4.0
|
830℃
| 0.481
| 0.575
| 0.626
| 0.669
| 0.685
|
890℃
| 0.579
| 0.691
| 0.694
| 0.699
| 0.699
|
950℃
| 0.669
| 0.714
| 0.714
| 0.714
| 0.714
|
?
①分析数据可以得出,该制备氯化钾的反应是?(填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率?。(式量:KAlSi3O8–278? NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是?(写出两种)。
参考答案:(1)3? 2
(2)高?钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。
(3)O<Cl<Si<Al<Na<K
(4)Na
(5)①吸热 ②0.074 ③充分搅拌?将钾长石充分粉碎
本题解析:(1)硅原子的最外层电子排布式为3S23P2占据了3个轨道,有2种能量。
(2)钾离子半径大于钠离子,半径越大,离子键键能越低,熔点越低。氯化钠的熔点比氯化钾的高。
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子层越多原子半径越大,故原子半径K>Na>Al>Si>Cl>O。
(4)Na、Al、Si、Cl四种元素处于同一周期,氢氧化钠能与氢氧化铝、硅酸、高氯酸反应生成相应的盐与水,故答案为:Na;
(5)①由表中数据可知,温度越高钾元素的熔出率,说明升高温度,平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;② 1gKAlSi3O8 (s)中K的质量为:39/278=0.140g,
NaCl (l) +KAlSi3O8 (s)  ?KCl (l)+NaAlSi3O8 (s)。
?KCl (l)+NaAlSi3O8 (s)。
开始? 2g? 1g? 0
平衡? 0.699*74.5*0.140/39
转化? 0.699*74.5*58.5*0.140/39*74.5? 0.699*74.5/39
求得 0.699*74.5*58.5*0.140/39*74.5 =0.148,氯化钠的平衡转化率=0.148/2=0.074。
③950℃时,提高熔出钾的速率可以采取的措施是充分搅拌,反应物充分接触,反应速率加快,或将钾长石粉粹成更小的颗粒,增大反应物的接触面积,反应速率加快。
本题难度:一般
5、选择题 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是
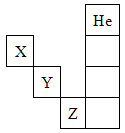
①X的气态氢化物与Y的最高价氧化物对应的水化物所生成的盐属于离子化合物
②Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质在常温下是液体,可与镁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有18种元素
A.①②③④
B.①②③④⑤
C.只有③⑤
D.只有①④
参考答案:B
本题解析:略
本题难度:一般