1、选择题 下列有关化学用语表示错误的是?
[?]
A.原子核内有10个中子的氧离子: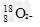
B.鸟粪石中2种阳离子的电子式分别为 ?
?
C.氧与氟形成的化合物OF2中,氧元素的化合价为+2价
D.在Mg18O晶体中,阴离子结构示意图可表示为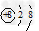
参考答案:B
本题解析:
本题难度:简单
2、简答题 A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子.请回答下列问题:
(1)C的单质分子的结构式为______;ED的电子式为______.
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为______.
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为______,由此可知CD和FD2中还原性较强的是______(填化学式).
(4)A、C、D、F四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为______.将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x,则混合溶液中酸根离子的浓度为______mol/L(用含x的代数式表示,混合后溶液体积变化忽略不计).
参考答案:A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色,则F为S元素,D为O元素;B的单质在D2中燃烧可生成BD和BD2两种气体,则B为C元素;C的原子序数介于碳、氧之间,则C为N元素;E的原子序数为B的两倍,则E为Mg;A元素的一种核素中不含中子,则A为H元素,
(1)C的单质为N2,分子N原子之间形成3对共用电子对,其结构式为N≡N;ED为MgO,由镁离子与氧离子构成,电子式为 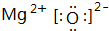 ,
,
故答案为:N≡N;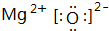 ;
;
(2)Mg在二氧化碳中燃烧生成碳与MgO,该反应的化学方程式为:2Mg+CO2点燃.2MgO+C,
故答案为:2Mg+CO2点燃.2MgO+C;
(3)SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀硫酸钡和无色气体NO,有关反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,由此可知,还原性NO<SO2,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+;SO2;
(4)H、N、O、S四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为NH4HSO4,将0.01mol/L的NH4HSO4溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,氢氧化钡过量,反应后溶液中钡离子浓度约是:0.03mol/L-0.01mol/L2=0.01mol/L,硫酸钡的Ksp=x,根据溶度积表达式可知,溶液中硫酸根离子的浓度为:x0.01mol/L=100xmol/L,
故答案为:NH4HSO4;100x.
本题解析:
本题难度:一般
3、选择题 下列化合物中既有离子键又有共价键的是( )
A.KBr
B.NH4Cl
C.HF
D.O3
参考答案:B
本题解析:
本题难度:简单
4、简答题 A、B、C、D、E五种短周期主族元素的原子序数依次增大,且知:①其原子半径大小关系是C>D>E>B>A;②A、C同主族,B、D同主族;③B是地壳中含量最多的元素.请填写以下空白:
(1)化合物C2B2的电子式为______.
(2)B、D分别与A形成的结构相似的两种化合物的沸点高低为______>______,原因是______.
(3)已知lgA与E的单质反应时放出92.3kJ热量,写出该反应的热化学方程式______.
(4)B、C、D可以形成一种常见化合物M,M的水溶液呈碱性的原因是______(用离子方程式表示);M与E的单质反应的离子方程式为______.
(5)以上元素能形成的具有漂白性的化合物有______(至少写三种).
参考答案:A、B、C、D、E五种短周期主族元素的原子序数依次增大,B是地壳中含量最多的元素,则B为氧元素;B、D同主族,则D为硫元素;E的原子序数最大,故E为Cl元素;A、C同主族,原子半径大小关系是C>D>E>B>A,A不可能处于ⅦA族,故A为氢元素、C为Na元素,
(1)化合物Na2O2的电子式为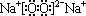 ,
,
故答案为: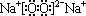 ;
;
(2)O、S与H形成的结构相似的两种化合物分别为H2O、H2S,由于H2O分子之间存在氢键,故沸点H2O>H2S,
故答案为:H2O、H2S;H2O分子之间存在氢键;
(3)lg氢气与氯气反应时放出92.3kJ热量,1mol氢气反应放出的热量为92.3kJ×1mol×2g/mol1g=184.6kJ,该反应的热化学方程式为:H2(g)+Cl2(g)=HCl(g)△H=-184.6kJ/mol,
故答案为:H2(g)+Cl2(g)=HCl(g)△H=-184.6kJ/mol;
(4)O、Na、D形成一种常见化合物M,M的水溶液呈碱性,则M为Na2SO3,Na2SO3溶液中SO32-水解SO32-+H2O?HSO3-+OH-,平衡水的电离平衡,溶液呈碱性;
Na2SO3与氯气反应的离子方程式为:SO32-+Cl2+H2O=SO42-+Cl-+H+,
故答案为:SO32-+H2O?HSO3-+OH-;SO32-+Cl2+H2O=SO42-+Cl-+H+;
(5)以上元素能形成的具有漂白性的化合物有:H2O2、Na2O2、SO2、HClO等,
故答案为:H2O2、Na2O2、SO2、HClO等.
本题解析:
本题难度:一般
5、选择题 “类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的(?)
A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C.二甲苯的沸点顺序是:邻二甲苯>间二甲苯 >对二甲苯;则羟基苯甲醛的沸点顺序也是:邻羟基苯甲醛 >对羟基苯甲醛
D.根据“相似相溶”,乙醇能与水以任意比互溶,则戊醇也能与水以任意比互溶
参考答案:A
本题解析:略
本题难度:简单