1、选择题 下列说法正确的是( )
A.短周期元素形成离子后,最外层均达8电子稳定结构
B.多电子原子中,在离核较近的区域运动的电子能量较低
C.非金属元素组成的化合物中只有共价键
D.HF、HCl、HBr、HI的热稳定性和还原性依次增强
2、填空题 请回答下面问题
(1)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表
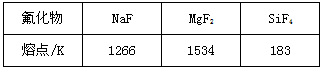
|
解释表中氟化物熔点差异的原因:____________________________________
(2)CO的结构可表示为C≡O,N2的结构可表示为N≡N。下表是两者的键能数据:(单位:kJ·mol-1)

CO与N2的结构相似,分子中都含有共价三键,其中含有___________个π键;结合数据说明CO比N2活泼的原因:____________________________________
3、选择题 下列说法正确的是
[? ]
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
4、选择题 在KMnO4中,Mn的化合价是( ? )
A.+2
B.+4
C.+6
D.+7
5、填空题 (18分)下表中a、b、c…为周期表中部分元素,回答下列问
a
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| f
| y
| h
| i
| ?
|
?
| b
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| e
| ?
| ?
| ?
| j
| ?
|
c
| ?
| ?
| ?
| ?
| ?
| ?
| d
| ?
| ?
| ?
| g
| ?
| l
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)在表中用线画出元素周期表的边界
(2)请写出上述元素d3+的核外电子排布式?;
(3)请比较y、h、i三种元素的第一电离能由大到小的顺序?(写元素符号),判断依据是:?
(4)请写出e元素的原子价电子轨道表示式?;
(5)ya3分子的电子式是??,其分子的空间构型是??。
(6)e元素最高价氧化物对应的水化物呈_______性(酸性、碱性或两性),用离子方程式说明____________________________________________?。