1、填空题 短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同) 。
。
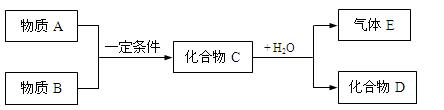
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的电子式:____________________
(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因:
_________________________________________________________________________
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
_________________________________________________________________________
(3)若C是一种气体,D是一种强酸,且E与A相同,则C与水反应的化学方程式为(请标出电子转移方向和数目):
_________________________________________________________________________
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,那么化合物D是_____________。
参考答案:
本题解析:略
本题难度:一般
2、填空题 下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
1
| ①
| ?
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ?
| ⑦
| ?
| ⑧
| ⑨
|
4
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种):?。
(2)比较:②、③、④、⑤的第一电离能:?>?>?>?(写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是?;碱性最强的化合物的电子式是:??
(4)具有两性的最高价氧化物是??(填化学式);写出其与氢氧化钠溶液反应的离子方程式:?。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
电离能I(eV)
| A
| B
| C
| D
| E
|
I1
| 11.3
| 13.6
| 5.2
| 7.6
| 6.0
|
I2
| 24.4
| 35.1
| 49.3
| 15.0
| 18.8
|
I3
| 47.9
| 54.9
| 71.6
| 80.1
| 28.4
|
I4
| 64.5
| 77.4
| 98.9
| 109.2
| 112.0
|
I5
| 392.1
| 113.9
| 138.3
| 141.3
| 153.7
|
?
试回答:表中可能为非金属元素的是?(填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是? ?。
参考答案:(1)CH4? NH3? H2O? (任写两种)。
(2)N>O>C>? Na?(写元素符号)。
(3)HClO4? KOH电子式: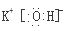
(4)Al2O3? Al2O3?+2OH- =2AlO 2-+H2O。
(5)A? B;? D的P轨道全空,能量更低更稳定。
本题解析:(1)①~⑩元素分别是H、C、N、O、Na、Al、P、Cl、Ar、K,由元素组成的分子中电子总数为10的分子有CH4? NH3? H2O? HF等
(2)②、③、④、⑤元素分别是C、N、O、Na,根据电离能的递变规律,N最外层半充满,第一电离能最大,Na的电子层数最多,第一电离能最小,O、C位居其中,所以第一电离能的大小顺序为N>O>C?>? Na
(3)元素的非金属性越强,其最高价含氧酸的酸性越强,所以酸性最强是酸是氯元素对应的高氯酸,化学式为HClO4,金属性越强,其最高价氧化物的水化物的碱性越强,所以碱性最强的碱是KOH,其电子式为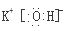
(4)具有两性的最高价氧化物是Al2O3;其与氢氧化钠溶液反应的离子方程式:Al2O3 +2OH- =2AlO 2-+H2O
(5)非金属元素的第一电离能比较大,通过表中数据可以判断第一电离能较大的为非金属元素,AB可能属于非金属;E的前三电离能较小,第四电离能突然增大,说明此元素的化合价为+3,为铝元素,而D的第一电离能比E略大且相邻,所以D为镁,原因是镁的p轨道全空,能量更低更稳定
本题难度:一般
3、选择题 下列关于物质结构、性质的说法正确的是
A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C
B.同一周期元素的原子,半径越小越容易失去电子
C.K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈
D.离子化合物中可能含有共价键,共价化合物中可能含有离子键
参考答案:C
本题解析:A项,判断非金属性强弱时,应根据最高价氧化物对应水化物酸性强弱来比较,错误;B项,同周期元素的原子,半径越小,越容易得电子,错误;D项,共价化合物中一定不含离子键,错误。
本题难度:简单
4、填空题 (10分)A,B,C,D是四种短周期元素,它们的原子序数依次增大,其中A,C及B,D分别是同一主族元素,B,D元素的原子核中质子数之和是A,C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体.
(1)写出四种元素的名称:
A_________;B_________;C_________;D_________;
(2)写出两种均含A,B,C,D四种元素的化合物相互间发生反应,且生成气体的离子方程式____________________________________________________;
(3)写出C和D两元素形成化合物的电子式:_________________________;
(4)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在一极通入A的单质,另一极通入B的单质,写出该电池发生的电极反应式:A极________________________;
B极________________________;
(5)若消耗标准状况下A气体11.2L,该电池能提供的电量为________C.
参考答案:(1)氢 氧 钠 硫 (2)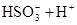

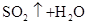
(3)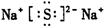 (4)
(4)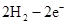

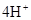
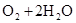
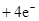


(5)96320
本题解析:根据元素的结构及有关性质可知,A,B,C,D分别是H、O、Na、S。
(1)名称分别是氢、氧、钠、硫。
(2)符合条件的两种物质分别是硫酸氢钠和亚硫酸氢钠,方程式为HSO3-+H+=SO2↑+H2O。
(3)钠和S都是活泼的金属和非金属,形成的化学键是离子键,电子式为 。
。
(4)原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应,所以氢气在负极通入,氧气在正极通入。又因为溶液显碱性,所以电极反应式为负极: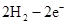

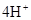 ,正极:
,正极: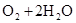
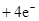

 。
。
(5)氢气是0.5mol,失去1mol电子,所以该电池能提供的电量为6.02×1023×1.6×10-19=96320C。
本题难度:一般
5、选择题 俄罗斯科学家宣布在实验中获得了 和
和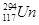 两种新原子。下列有关
两种新原子。下列有关 和
和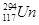 的说法错误的是(? )
的说法错误的是(? )
A.质量数均超过质子数的两倍
B.互称为同位素
C.中子数分别为176、177
D.是同一种核素
参考答案:D
本题解析: 和
和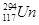 是Un元素的两种不同核素,二者互为同位素;这两种原子的质子数都是117,中子数分别为176、177,质量数分别为293、294,质量数均超过质子数的两倍。
是Un元素的两种不同核素,二者互为同位素;这两种原子的质子数都是117,中子数分别为176、177,质量数分别为293、294,质量数均超过质子数的两倍。
本题难度:简单