1、选择题 在下列溶液中,各组离子一定能够大量共存的是
[? ]
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.常温下c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液中:K+、SO42-、Cl-、H+
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列各组离子在溶液中能大量共存的是
A.NH4+、K+、Cl-、OH-
B.H+、Na+、NO3-、HCO3-
C.Mg2+、NH4+、NO3-、SO42-
D.Ag+、H+、SO42-、Cl-
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中NH4+和OH-不能大量共存;B中H+和HCO3-不能大量共存;D中Ag+和SO42-、Cl-均不能大量共存,答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:简单
3、选择题 在pH=1的某无色溶液中能大量共存的离子组是?(? )
A.NH4+、Mg2+、SO42-、Cl-
B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+ 、SO42-、Cl-
D.Na+、Ca2+、AlO2-、Cl-
参考答案:A
本题解析:在pH=1的某无色溶液中,溶液呈酸性,排除BD;无色溶液,排除C。
本题难度:一般
4、选择题 在密闭容器中进行X2(g)+4Y2(g)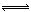 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是?
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是?
A.c(X2)="0.15" mol·L-1
B.c(Y2)="0.9" mol·L-1
C.c(Z2)="0.3" mol·L-1
D.c(Q2)="0.5" mol·L-1
参考答案:B
本题解析:该反应是可逆反应,所以反应物和生成物的浓度不可能是0,据此可知,B不正确,因为如果c(Y2)="0.9" mol/L,则需要消耗Z2、Q2的浓度分别是0.25mol/L和0.375mol/L,显然这是不可能的,答案选B。
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确可逆反应的特点,然后灵活运用即可。
本题难度:简单
5、计算题 将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
参考答案:(6分) (1)V(SO2)= 4.48L?(3分)(2)c(H +)=0.84mol/L?(3分)
本题解析:(1)测得c(Cu2+)="0.3" mol/L
则溶液中硫酸铜的物质的量是0.3mol/L×1L=0.3mol
其中铜离子的质量是0.3mol×64g/mol=19.2g
则原固体混合物中氧元素的质量是20.8g-19.2g=1.6g
物质的量是1.6g÷16g/mol=0.1mol
所以氧化铜的物质的量是0.1mol
质量是8g
则铜的质量是20.8g-8g=12.8g
物质的量是12.8g÷64g/mol=0.2mol
所以根据反应的化学方程式可知
Cu+2H2SO4(浓)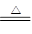 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
生成的SO2是0.2mol
标准状况下是0.2mol×22.4L/mol=4.48L
(2)氧化铜和铜消耗的硫酸的物质的量分别是0.1mol和0.4mol
则剩余硫酸的物质的量是0.05L×18.4mol/L-0.5mol=0.42mol
所以氢离子的物质的量是0.84mol
氢离子的浓度是0.84mol÷1L=0.84mol/l
点评:该题是中等难度的试题,试题综合性强,贴近高考。试题注重基础,侧重能力的培养和训练。有利于培养学生的逻辑推理能力,提高学生分析问题、解决问题的能力。该题的关键是利用好守恒法在计算中的应用,常用的守恒法包括质量守恒定律、电子得失守恒、电荷守恒以及原子守恒。
本题难度:一般