1、选择题 下列可用氢键来解释的是?
A.浓的氢氟酸溶液中存在HF 和H2F
和H2F
B.SiH4沸点比CH4高
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解
参考答案:A
本题解析:原子半径小、吸引电子能力强的F、O、N与H原子间易形成氢键,氢键的存在可能会形成缔合物,影响物质的物理性质。B项中,因SiH4的相对分子质量比CH4的相对分子质量大,从而造成前者分子间作用力大,C、D两项均体现物质的化学性质,故只有A项成立。
本题难度:一般
2、选择题 下列各组化合物中化学键类型不同的是
[? ]
A.NaCl和HNO3
B.H2O和NH3
C.CaF2和 CsCl
D.CCl4和N2O
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列分子的电子式书写正确的是
[? ]
A.氨气 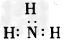
B.四氯化碳 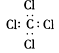
C.氮气 
D.二氧化碳 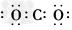
参考答案:C
本题解析:
本题难度:简单
4、选择题 CO.BF3.CCl4.CH4都是非极性分子,而NH3.H2S.H2O都是极性分子。由此推出ABn型分子是非极性分子的经验规律正确的是
[? ]
A.所有原子在同一平面内
B.分子中不含氢原子
C.A的原子量小于B
D.在ABn分子中A原子化合价的绝对值等于其最外层电子数
参考答案:D
本题解析:
本题难度:一般
5、填空题 (8分,除(4)题2分外,每空1分)元素X和Y属于同一主族。负二价的元素X和氢的化合物在通常状况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物,在这两种化合物中,X的质量分数分别为50%和60%。
(1)在元素X和元素Y两种元素形成的化合物中,写出X质量分数为50%的化合物的化学式________;该分子中中心原子上的孤电子对数为?,该分子VSEPR模型名称________,分子立体构型名称________?
(2)写出X的质量分数为60%的化合物的σ键电子对数为_______?,分子立体构型为_______??
(3) 写出由宇宙中最丰富的元素Z、短周期中原子半径最大的主族元素W,与X、Y这四种元素组成的两种物质发生化学反应的方程式?
参考答案:(8分,除(4)题2分外,每空1分)
(1)SO2 ;1; 平面三角形;Ⅴ形 (2) 3?平面三角形? (3)?略
本题解析:略
本题难度:一般