1、选择题 亚硝酸(HNO2)既可以做氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的物质是( )
A.N2
B.N2O3
C.HNO3
D.NO2
参考答案:亚硝酸中N元素的化合价为+3价,当它在反应中作氧化剂时,N元素的化合价降低,
则可能生成的物质是N2,而选项BCD中N元素的化合价均≥3,
故选:A.
本题解析:
本题难度:简单
2、填空题 水在很多的反应中,起到及其重要的作用.根据下面水参与的反应,回答问题:
①NaH+H2O═NaOH+H2↑?(NaH中H为-1价)?②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑?④CO2+H2O═H2CO3
⑤2H2O
2H2↑+O2↑? ?⑥2F2+2H2O═4HF+O2
(1)水只作氧化剂的是______;(填写序号,下同)水只作还原剂的是______;水既作氧化剂,又做还原剂的是______;水既不是氧化剂,又不是还原剂的氧化还原反应是______.
(2)水作氧化剂时,被还原的元素是______(填元素符号),若电解1mol水,转移的电子数为______个.
参考答案:(1)①该反应中NaH中的H元素失电子化合价升高,H2O中的H元素得电子化合价降低,所以氢化钠作还原剂,水作氧化剂;
?②该反应中水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;
③该反应中钠失电子化合价升高,水中氢元素得电子化合价降低,所以水作氧化剂;?
④该反应中,各元素的化合价都不变,所以不是氧化还原反应,水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;
⑤该反应中,水中的H元素得电子化合价降低,水中的O元素失电子化合价升高,所以水既是氧化剂又是还原剂;
⑥该反应中,水中O元素失电子化合价升高,所以水中还原剂;
故答案为:①③;⑥;⑤;②
(2)水作氧化剂时,水中的H元素得电子被还原,
设转移电子数为x
2H2O?电解?.?2H2↑+O2↑?转移电子?
2mol? 4NA
1mol? x
x=2NA
故答案为:H,2NA.
本题解析:
本题难度:一般
3、简答题 氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:
2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O
(1)用双线桥表示上述反应中电子转移的方向和数目______.
(2)浓盐酸在该反应中表现的性质是______(填序号).
①只有还原性?②还原性和酸性?③只有氧化性?④氧化性和酸性
(3)上述反应产生0.2?mol?Cl2时,转移的电子数约为______.
参考答案:(1)KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-,则双线桥表示反应中电子转移的方向和数目
为
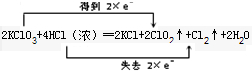
,故答案为:

;
(2)由反应可知,HCl中部分Cl元素的化合价升高,体现还原性,部分化合价不变生成盐表现酸性,故答案为:②;
(3)由反应可知,生成1molCl2时,转移2mol电子,则产生0.2?molCl2时,转移的电子数约为0.4×6.02×1023=2.408×1023,故答案为:2.408×1023.
本题解析:
本题难度:一般
4、简答题 维生素C简称VC,化学式为C6H8O6,是一种水溶性物质,其水溶液具有弱酸性,水果、蔬菜中含量较多.人体内若缺少VC易患坏血病,故VC又称“抗坏血酸”.VC与单质碘(Ⅰ2)反应的化学方程式为:C6H8O6+I2=C6H6O6+2HI
请回答下列问题:
(1)上述反应______(填“是”或“不是”)氧化还原反应,VC的作用是______;
(2)血液里,运输氧的血红蛋白中含有亚铁离子,人之所以患坏血病,是因为人们从食物中摄取的铁主要是+3价的铁,不能被直接吸收利用.据此推测,VC在抗坏血病方面的作用原理是______.
参考答案:(1)维生素C能与单质碘发生反应:C6H8O6+I2→C6H6O6+2HI,反应物中碘元素从0价,变为产物HI中的-1价,有元素化合价变化,是氧化还原反应,C6H8O6中氢元素为+1价,氧元素为-2价,则碳元素为+23价,产物C6H6O6中,碳元素为+1价,化合价升高,是还原剂,表现还原性,
故答案为:是;还原剂;
(2)由题意知,Fe3+是氧化剂,维生素C是还原剂,具有还原性,将从食物中获取的Fe3+还原为Fe2+,
故答案为:利用其还原性将人体从食物中获取的+3价铁还原为+2价铁.
本题解析:
本题难度:一般
5、简答题 (1)在下列反应中,用序号填空:
A.2F2+2H2O=4HF+O2?B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2?D.2H2O
2H2↑+O2↑
水只作氧化剂的是______,水只作还原剂的是______,水既作氧化剂又作还原剂的是______,水既不作氧化剂又不作还原剂的是______.
(2)用“双线桥法”表示下列反应中电子转移的方向和总数.
Fe2O3+3CO2Fe+3CO2
(3)用“单线桥法”表示下列反应中电子转移的方向和总数
Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
(4)赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应发生:Cu2S+2Cu2O?6Cu+SO2↑,该反应中氧化产物与还原产物的质量比______.
参考答案:(1)A中F元素的化合价降低,O元素的化合价升高,则水只作还原剂;
B中Na元素的化合价升高,H元素的化合价降低,则水只作氧化剂;
C中各元素的化合价都没有发生变化,属于非氧化还原反应,则水既不作氧化剂又不作还原剂;
D中H元素的化合价降低,O元素的化合价升高,则水既作氧化剂又作还原剂;
故答案为:B;A;D;C;
(2)在反应Fe2O3+3CO?高温?.?2Fe+3CO2中,Fe元素的化合价由+3降低为0,得2×3e-,C元素的化合价由+2升高到+4,失3×2e-,则
用“双线桥法”表示反应中电子转移的方向和总数为
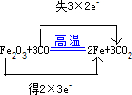
,答:用“双线桥法”表示反应中电子转移的方向和总数为

;
(3)在反应Cu+4HNO3(浓)?△?.?Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合价由0升高到+2价,失2e-,N元素的化合价由+5价降低为+4价,得2×e-,则
用“单线桥法”表示反应中电子转移的方向和总数为
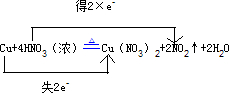
,
答:用“单线桥法”表示反应中电子转移的方向和总数为
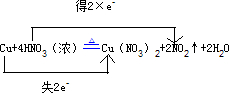
;
(4)Cu2S+2Cu2O?△?.??6Cu+SO2↑中6个Cu原子得到电子,1个S原子失去电子,该反应中的还原产物为Cu,氧化产物为SO2,其物质的量之比为6:1,
则反应中氧化产物与还原产物的质量比为6mol×64g/mol:1mol×64g/mol=6:1,故答案为:6:1.
本题解析:
本题难度:一般