1、选择题 以下物质间的每步转化通过一步反应能实现的是
[? ]
A.Al→Al2O3→Al(OH)3→NaAlO2
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.S→SO3→H2SO4→MgSO4
D.N2→NO→NO2→HNO3
参考答案:BD
本题解析:
本题难度:简单
2、选择题 下列实验中仪器的末端必须插入液面以下的是( )
①制备氢气的简易装置中用来加入稀硫酸的长颈漏斗
②实验室用MnO2和浓盐酸制备氯气装置中的分液漏斗
③用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2操作中的胶头滴管
④将氯气溶于水制取氯水时的导气管
⑤蒸馏石油时的温度计.
A.③⑤
B.①③④
C.②④⑤
D.全部
参考答案:B
本题解析:
本题难度:一般
3、填空题 Fe(OH)2在水中是白色沉淀,在空气中易被氧化,有关的实验现象是______,反应的化学方程式是______.实验室可用下面两种方法制得白色的Fe(OH)2沉淀:
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)若FeSO4溶液中含有Fe3+,可加入Fe粉使其还原,反应的离子方程式是______.
(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是______.
方法二:在如图装置中,试管Ⅰ里加入铁屑、稀H2SO4,试管Ⅱ里加入NaOH溶液,为了制得白色Fe(OH)2沉淀,实验时打开止水夹,塞紧塞子后的实验步骤是______.这样生成的Fe(OH)2沉淀能较长时间保持白色.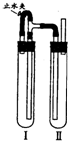
参考答案:氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,氢氧化铁是红褐色沉淀,所以看到的现象是:白色沉淀先变成灰绿色,最后变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀先变成灰绿色,最后变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(1)铁离子具有氧化性,能氧化铁生成亚铁离子,离子反应方程式为:2Fe3++Fe=3Fe 2+,
故答案为:2Fe3++Fe=3Fe 2+;
(2)煮沸蒸馏水可除去其中溶解的O2,故答案为:煮沸;
(3)Fe(OH)2很容易被空气中的氧气氧化,实验时生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,避免生成的?Fe(OH)2沉淀接触O2而生成氢氧化铁,
故答案为:避免生成的?Fe(OH)2沉淀接触O2;
(4)打开止水夹,Fe与H2SO4反应生成H2充满整个装置,反应一段时间后关闭止水夹,左侧试管内气压升高,反应生成的Fe2+沿导管进入右侧试管与NaOH反应生成白色沉淀Fe(OH)2.若过早关闭止水夹,使左侧试管中的硫酸压入右侧试管中,将NaOH中和,则得不到Fe(OH)2溶液,
故答案为:检验试管Ⅱ出口处排出的氢气的纯度,当排出的H2纯净时,再夹紧止水夹.
本题解析:
本题难度:一般
4、填空题 按要求进行书写:
(1)氯化钡的电离方程式:___________
(2)氢氧化亚铁在空气中被氧化的化学方程式:___________
(3)过氧化钠与水反应的化学方程式:___________
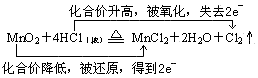
(4)在化学方程式上用双线桥法表示电子转移的方向及数目:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
参考答案:(1)BaCl2 == Ba2+ + 2Cl-
(2)4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
(3)2Na2O2 + 2H2O == 4NaOH +O2↑
(4)
本题解析:
本题难度:一般
5、简答题 (1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式______.
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.原因是______(用化学方程式表式).
(3)向100mL水中投入Na和Al共16克,充分反应后分析剩余金属1g.计算放出H2的体积为______升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/LHCl,当生成7.8克沉淀时,加入盐酸的体积为______mL.
(5)向一定量的Fe、Fe2O3和CuO混合物投入120mL2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为______(设滤液体积为120mL)mol/L.
参考答案:(1)高温下,碳酸钠、碳酸钙分别和二氧化硅反应生成硅酸盐和二氧化碳,反应方程式分别为:Na2CO3+SiO2 高温.Na2SiO3+CO2↑、CaCO3+SiO2高温.CaSiO3+CO2↑,故答案为:Na2CO3+SiO2 高温.Na2SiO3+CO2↑、CaCO3+SiO2高温.CaSiO3+CO2↑;
(2)氢氧化亚铁不稳定,易被氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)=15g23+27×2323g/mol=0.3mol,n(Al)=15g23+27×2727g/mol=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;
(4)n(Al(OH)3)=7.8g78g/mol=0.1mol<0.3mol,一种情况是:铝元素存在于偏铝酸钠和氢氧化铝中,
此时盐酸少量,只能沉淀一部分AlO2-,根据NaAlO2+HCl+H2O=Al(OH)3↓+NaCl得,n(HCl)=n(Al(OH)3)=0.1mol,则盐酸体积=0.1mol1mol/L=100mL;
另一种情况是铝元素存在于氯化铝和氢氧化铝中,此时盐酸较多,先把AlO2-全部沉淀,后又将部分沉淀溶解,生成氢氧化铝需要n(HCl)=n(NaAlO2)=n(Al(OH)3)=0.3mol,溶解Al(OH)3生成氯化铝需要盐酸的n(HCl)=3n(AlCl3)=3×(0.3-0.1)mol=0.6mol,所以需要盐酸体积=0.3mol+0.6mol1mol/L=900mL,
故答案为:100或900;
(5)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量=12n(NaOH)=12×2mol/L×0.04L=0.04mol,
剩余的硫酸的物质的量=0.264mol-0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度=0.224mol0.12L=1.87mol/L,
故答案为:1.87.
本题解析:
本题难度:一般