1、简答题
元素
Mn
Fe
|
电离能(?kJ?mol-1)
I1
717
759
I2
1509
1561
I3
3248
2957
|
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为______,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是:______
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氯和亚铁离子〔Fe(CN)64-〕中的配体CN-中C原子的杂化轨道类型是______,写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
(3)三氯化铁常温下为固体,熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为:______
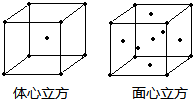
(4)金属铁的晶体在不同的温度下有两种堆积方式,晶体分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为:______.
参考答案:(1)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2.
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
故答案为:3d54s2.?由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)①Fe原子或离子含有空轨道.所以,与Fe原子或离子形成配合物的分子或离子应具有孤对电子.
故答案为:具有孤对电子.
②CN-中C原子与N原子键以三键连接,三键中有1个δ键、2个π键,C原子还有一对孤对电子,杂化轨道数2,C原子采取sp杂化.
CN-含有2个原子,价电子总数为4+5+1=10,故其等电子体为氮气分子等,结构式为N≡N.
故答案为:sp;N≡N
(3)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体.
故答案为:分子晶体.
(4)面心立方结构晶胞中铁原子数为1+6×12=4;
体心立方结构晶胞中铁原子数为1+8×18=2.
属于两种结构的铁原子数之比为4:2=2:1.
故答案为:2:1
本题解析:
本题难度:一般
2、简答题 人体中含量位于前6名的元素依次是:氧、碳、X、氮、钙、磷.根据要求用以上元素完成下列填空:
(1)X是______(写元素符号,下同).能量最高的亚层电子云呈球形的元素有______.
(2)形成化合物种类最多的元素的最简氢化物的电子式为______;该分子为非极性分子的原因是______.
(3)能证明C、N、O非金属性递变规律的事实是______.
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.NO2、CO2和C3N4中元素的化合价
d.气态氢化物的稳定性
(4)氮元素的另一种气态氢化物肼可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的.肼燃烧时的能量变化如图所示,则该反应的热化学方程式为______.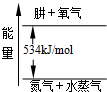
参考答案:(1)人体中含量位于前6名的元素依次是:氧、碳、氢、氮、钙、磷,故X为H元素,s能级的电子云为球形,能量最高的亚层电子云呈球形,说明该元素最高能级为ns,符合条件的有H、Ca,故答案为:H;H、Ca;
(2)形成化合物种类最多的元素为C元素,最简氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对,电子式为:
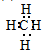
,为正四面体结构,分子中正负电荷的重心重合,为非极性分子,故答案为:
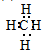
;分子中正负电荷的重心重合,为非极性分子;
(3)a.氧元素没有含氧酸,不能利用最高价比较氧元素与C、N元素的非金属性,故a错误;
b.单质与H2反应的难易程度,说明单质的氧化性强弱,单质的结构不同,不能说明元素的非金属性,故b错误;
c.化合价说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,故NO2中氧元素为-2价,氧元素吸引电子能力更强,故非金属性O>N,CO2中,中氧元素为-2价,氧元素吸引电子能力更强,故非金属性O>C,C3N4中N元素为-3价,N元素吸引电子能力更强,故非金属性N>O,可以比较,故c正确;
d.非金属性越强,气态氢化物越稳定,故气态氧化物的稳定性可以比较非金属性强弱,故d正确;
故答案为:cd;
(4)由肼燃烧时的能量变化图可知,1mol肼燃烧生成氮气与水蒸气,放出的热量为534kJ,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol.
本题解析:
本题难度:一般
3、填空题 [化学-选修物质结构与性质]
第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.
(1)Pt与Ni在周期表中位于同一族,写出基态Ni原子核外电子排布式______.
(2)金属Pt内部原子的堆积方式与铜及干冰中CO2相同,图正方体是Pt晶胞示意图,叙述Pt原子在晶胞中位置:______.
(3)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为______分子(填“极性”或“非极性”);XeO3分子中中心原子的杂化类型为______;XeO3分子实际空间构型为______
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是______.
参考答案:(1)Ni的原子序数为28,根据能量最低原理和洪特规则可写出基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)铜的堆积模型为最紧密堆积,配位数为12,铜原子位于顶点和面心,与二氧化碳分子晶胞结构相似,
故答案为:正方体的八个顶点和六个面心;
(3)XeO3分子中含有3个δ键和一个孤电子对,为三角锥形分子,结构不对称,为极性分子,杂化方式为sp3杂化
故答案为:极性;sp3;三角锥形;
(4)HF含有氢键,沸点较高,易液化,故答案为:HF.
本题解析:
本题难度:一般
4、选择题 下列电子层中,包含有f能级的是
[? ]
A.K电子层
B.L电子层
C.M电子层
D.N电子层
参考答案:D
本题解析:
本题难度:简单
5、选择题 元素A的原子最外层有6个电子,元素B的原子最外层有3个电子,则A与B形成的化合物的化学式可能是( )
A.A2B3
B.B2A3
C.B2A
D.A2B
参考答案:B
本题解析:
本题难度:简单