1、简答题 人体中含量位于前6名的元素依次是:氧、碳、X、氮、钙、磷.根据要求用以上元素完成下列填空:
(1)X是______(写元素符号,下同).能量最高的亚层电子云呈球形的元素有______.
(2)形成化合物种类最多的元素的最简氢化物的电子式为______;该分子为非极性分子的原因是______.
(3)能证明C、N、O非金属性递变规律的事实是______.
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.NO2、CO2和C3N4中元素的化合价
d.气态氢化物的稳定性
(4)氮元素的另一种气态氢化物肼可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的.肼燃烧时的能量变化如图所示,则该反应的热化学方程式为______.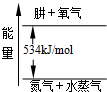
参考答案:(1)人体中含量位于前6名的元素依次是:氧、碳、氢、氮、钙、磷,故X为H元素,s能级的电子云为球形,能量最高的亚层电子云呈球形,说明该元素最高能级为ns,符合条件的有H、Ca,故答案为:H;H、Ca;
(2)形成化合物种类最多的元素为C元素,最简氢化物为CH4,分子中C原子与H原子之间形成1对共用电子对,电子式为:
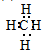
,为正四面体结构,分子中正负电荷的重心重合,为非极性分子,故答案为:
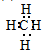
;分子中正负电荷的重心重合,为非极性分子;
(3)a.氧元素没有含氧酸,不能利用最高价比较氧元素与C、N元素的非金属性,故a错误;
b.单质与H2反应的难易程度,说明单质的氧化性强弱,单质的结构不同,不能说明元素的非金属性,故b错误;
c.化合价说明共用电子对偏移方向,化合物中表现负价的元素,对键合电子的吸引力更强,非金属性更强,故NO2中氧元素为-2价,氧元素吸引电子能力更强,故非金属性O>N,CO2中,中氧元素为-2价,氧元素吸引电子能力更强,故非金属性O>C,C3N4中N元素为-3价,N元素吸引电子能力更强,故非金属性N>O,可以比较,故c正确;
d.非金属性越强,气态氢化物越稳定,故气态氧化物的稳定性可以比较非金属性强弱,故d正确;
故答案为:cd;
(4)由肼燃烧时的能量变化图可知,1mol肼燃烧生成氮气与水蒸气,放出的热量为534kJ,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol.
本题解析:
本题难度:一般
2、选择题 下列是一些原子的2p能级和3d能级中电子排布的情况,其中正确的是( )
A.

B.

C.

D.

参考答案:BD
本题解析:
本题难度:简单
3、选择题 在氯化氢分子中,形成共价键的原子轨道是
[? ]
A.氯原子的2p轨道和氢原子的1s轨道
B.氯原子的2p轨道和氢原子的2p轨道
C.氯原子的3p轨道和氢原子的1s轨道
D.氯原子的3p轨道和氢原子的3p轨道
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列原子各电子层中电子数不合理的是
[? ]
A.21Sc:K(2) L(8) M(8) N(3)
B.20Ca:K(2) L(8) M(8) N(2)
C.12Mg:K(2) L(8) M(2)
D.9F:K(2) L(7)
参考答案:A
本题解析:
本题难度:简单
5、选择题 X原子的最外层电子的排布为ns2np4,则X的氢化物的化学式是( )
A.HX
B.H2X
C.XH3
D.XH4
参考答案:X原子的最外层电子的排布为ns2np4,在化学反应中可得2个电子达到8电子稳定结构,则最低化合价为-2价,则形成的氢化物的化学式为H2X,故选B.
本题解析:
本题难度:一般