预期现象和结论
步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用
______
步骤二:往试管I中,______
______
步骤三:______
______
参考答案:(1)在加热的条件下,当铁丝与浓硫酸接触时才能反应,当往上抽动铁丝时,铁丝与硫酸不接触,反应停止,所以用“可抽动的铁丝”的优点是便于控制反应的反应,故答案为:便于控制反应的反应和停止;
(2)SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,所以能说明有SO2气体产生的实验现象是品红溶液褪色,故答案为:品红溶液褪色;
(3)从D管口向装置A中大量鼓气,就可使装置中残留气体完全被吹出,气体被赶到从装置BC中通过,经过B时,二氧化硫被吸收,经过C时已经完全吸收,故答案为:从D管口向A中大量鼓气;
(4)①铁与浓硫酸反应,铁可能被氧化成Fe3+或Fe2+;对A中溶液的金属离子,可能有:只含有Fe3+;只含有Fe2+;
既有Fe2+,又有Fe3+,三种情况,故答案为:只含有Fe2+;
②设计实验方案验证假设3:须验证Fe3+和Fe2+,步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用,二价铁离子浅绿色,三价铁离子棕黄色,所以预期现象和结论是溶液有颜色;步骤二:往试管I中,滴加少量的淀粉KI溶液,若溶液变蓝色,Fe3+能氧化碘离子,把碘离子氧化成单质碘,单质碘与淀粉作用显蓝色,则说明原溶液中含有?Fe3+;步骤三:往试管II滴加到少量的?KMnO4溶液,Fe2+能还原高锰酸根离子,若溶液褪色,则说明原溶液中含有?Fe2+,结合步骤二溶液变蓝,则假设3正确,故答案为:
实验步骤预期现象和结论步骤二:滴加少量的淀粉KI溶液若溶液变蓝色,则原溶液中含有?Fe3+步骤三:往试管II滴加到少量的?KMnO4溶液若溶液褪色(浅红),则原溶液中含有?Fe2+,结合步骤二溶液变蓝,则假设3正确
本题解析:
本题难度:一般
2、选择题 对下列事实的解释正确的是( )
A.盛放AgNO3溶液应用棕色试剂瓶,是因为AgNO3见光易分解
B.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
C.向50mL18mol?L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应
参考答案:A、硝酸银见光易分解生成银、二氧化氮和氧气,所以盛放AgNO3溶液应用棕色试剂瓶,故A正确;
B、氯气和水反应生成盐酸和次氯酸,次氯酸有漂白性,但氯气没有漂白性,故B错误;
C、加热条件下,浓硫酸和铜反应硫酸铜、二氧化硫和水,但稀硫酸和铜不反应,所以向50mL18mol?L-1的H2SO4溶液中加入足量的铜片加热时,随着反应的进行,浓硫酸变成稀硫酸后和铜不反应,铜和浓硫酸充分反应后,被还原的H2SO4的物质的量小于0.45mol,故C错误;
D、常温下,浓硫酸和铝反应生成一层致密的氧化物薄膜阻止的进一步的反应,所以常温下,浓H2SO4可以用铝制容器贮存,发生了钝化现象,而不是不反应,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 对下列事实的解释正确的是
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸与铜屑反应来制取硝酸铜,说明浓硝酸具有挥发性
C.足量铁与稀硝酸反应后溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
参考答案:A
本题解析:分析:A.见光受热易分解的物质应盛放在棕色瓶内,避光保存;
B.根据消耗药品的量与生成气体对环境污染分析;
C.过量的铁与铁离子反应生成亚铁离子;
D.钝化是反应生成致密的氧化物保护膜,阻止金属与硝酸继续反应,硝酸为氧化性酸,与金属反应不能生成氢气,生成氮的氧化物等.
解答:A.浓硝酸通常保存在棕色的试剂瓶中避光保存,说明浓硝酸见光易分解,故A正确;
B.1mol铜反应需要消耗4mol浓硝酸,同时生成二氧化氮,污染环境,通常利用硝酸与氧化铜反应取硝酸铜,与浓硝酸挥发性无关,故B错误;
C.铁与硝酸反应首先生成硝酸铁,溶液呈浅绿色由过量的铁与铁离子反应生成亚铁离子所致,故C错误;
D.硝酸为氧化性酸,与锌反应不能生成氢气,生成氮的氧化物等,与钝化无关,故D错误;
故选A.
点评:本题考查硝酸的性质,难度不大,旨在考查学生对据此知识的理解掌握,注意基础知识的理解掌握.
本题难度:简单
4、实验题 为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)。
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
___________________________________________
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II.向VmL?c?mol/L酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III.取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
①其中不合理的方案是 ,理由是___________________________。
②选择合理方案的数据计算气体Y中SO2的体积分数(用含未知数的代数式表示)______。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持装置已省略)。
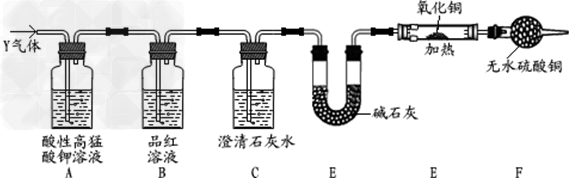
(3)装置A中试剂的作用是______________________。
(4)简述确认气体Y中含有CO2的实验现象:_________________________。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠? (填“可靠”或“不可靠”),简述理由:_______________________。
参考答案:(1)取少量X 溶液装于试管,向试管中滴加酸性高猛酸钾溶液,若溶液褪色,则证明X 溶液中含有Fe2+,否则不含Fe2+
(2)①方案III ;生成BaCO3和BaSO4两种沉淀,无法计算SO2的体积;
②66.7% (或 ×100% ) ×100% )
(3)吸收并除去SO2
(4)B 中品红溶液不褪色,C 中澄清石灰水变浑浊
(5)不可靠,空气中的水蒸气进入F 装置,也可使无水硫酸铜变蓝色。
本题解析:
本题难度:一般
5、选择题 浓硫酸一旦不小心溅入眼睛内,首先应采取如下哪种办法进行急救
[? ]
A.立即用大量清水冲洗,边冲洗边眨眼睛
B.先用干抹布擦,然后用水冲洗,再用3%~5%碳酸氢钠溶液清洗
C.迅速揉搓,边搓边流泪,将酸液稀释冲出
D.先用0.5%的碳酸氢钠溶液清洗,再用水冲洗
参考答案:A
本题解析:
本题难度:简单
|