1、选择题 如图所示,反应:X(气)+3Y(气)? 2Z(气)+Q(Q>0),在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为?(?)


参考答案:C
本题解析:由于正反应是气体体积减小的放热反应,所以压强越大、温度越低,Z的百分含量增大,故选C。
本题难度:一般
2、简答题 在500℃容积为2L的密闭容器中充入2mol?SO2和1mol?O2,发生下面反应:2SO2(g)+O2(g)

2SO3(g),经10秒后达到平衡,此时容器中SO3的浓度为0.9mol/L.求:
①SO2的转化率为______;?②O2的平衡浓度为______;?③SO2的平均反应速率为______.
参考答案:(1)生成的SO3的物质的量为n(SO3)=2L×0.9mol/L=1.8mol,
所以参加反应的SO2的物质的量为n(SO2)=n(SO3)=1.8mol.
SO2的转化率为1.8mol2mol×100%=90%
故答案为:90%
(2)浓度变化量之比等于化学计量数之比,△c(O2)=12△c(SO3)=12×0.9mol/L=0.45mol/L,
所以O2的平衡浓度为1mol2L-0.45mol/L=0.05mol/L.
故答案为:0.05mol/L
(3)10秒后内,以SO3表示速率为v(SO3)=0.9mol/L10min=0.09mol/(L?min),
速率之比等于化学计量数之比,所以v(SO2)=v(SO3)=0.09mol/(L?min),
故答案为:0.09mol/(L?min)
本题解析:
本题难度:一般
3、计算题 (8分)在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)  CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
参考答案:83.3%?逆反应
本题解析:设平衡时CO的转化率是x,则生成CO2和氢气的物质的量都是2x,消耗CO和水蒸气的物质的量是2x。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以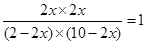 ,解得x=0.833,即转化率是83.3%。由于此时
,解得x=0.833,即转化率是83.3%。由于此时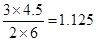 >1,所以反应向逆反应方向移动。
>1,所以反应向逆反应方向移动。
本题难度:一般
4、计算题 (7分)将1 mol CO和1 mol H2O充入某固定容积的容器中,在某条件下达到平衡:CO(g)+H2O(g) CO2(g)+H2(g),此时有
CO2(g)+H2(g),此时有 的CO转化为CO2。计算平衡状态下混合气体中CO2的体积分数。
的CO转化为CO2。计算平衡状态下混合气体中CO2的体积分数。
参考答案:33.3%
本题解析:由于该反应是气体分子数目不变的反应,所以最后混合气体共有2 mol,而生成的CO2是 ?mol,所以平衡时CO2的体积分数为:
?mol,所以平衡时CO2的体积分数为: ?mol×
?mol× ×100%=33.3%。
×100%=33.3%。
本题难度:一般
5、选择题 在一定条件下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为(?)
2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为(?)
A.3:2
B.2:3
C.1:3
D.1:2
参考答案:B
本题解析:设起始时充入容器的X与Y的物质的量分别是x和y,则根据方程式可知0.25x︰0.5y=1︰3,解得x︰y=2︰3,答案选B。
本题难度:一般