1、填空题 (1)浓度均为0.1mol/L的8种溶液:①HNO3?②H2SO4?③CH3COOH?④Ba(OH)2?⑤NaOH?⑥CH3COONa?⑦KCl?⑧NH4Cl,溶液pH值由小到大的顺序是:(填写编号)______.
(2)氯化铝水溶液呈______性,原因是(用离子方程式表示):______.把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______.
(3)在①pH=3的硫酸溶液和②pH=3的醋酸溶液中,分别投入足量锌粉,开始时反应速率大小为①______②(请填=、>、<,下同);反应结束后,生成的H2的体积(同温同压)①______②;当加水稀释相同的倍数,pH值①______②.
参考答案:(1)溶液呈碱性的有:④⑤⑥,其中④为二元强碱,①为一元强碱,⑥水解呈碱性,浓度相同时,PH:④>⑤>⑥;
溶液呈中性的有:⑦;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
PH:②<①<③<⑧,
故答案为:②①③⑧⑦⑥⑤④;
(2)氯化铝为强酸弱碱盐,Al3+的水Al3++3H2O
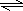
Al(OH)3+3H+,溶液呈酸性,
氯化铝的水解为吸热过程,加热促进水解,把AlCl3溶液蒸干,得到Al(OH)3,灼烧,分解生成Al2O3,最后得到的主要固体产物是Al2O3,
故答案为:酸;Al3++3H2O
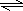
Al(OH)3+3H+;Al2O3;
(3)醋酸为弱酸,pH=3的硫酸溶液和pH=3的醋酸溶液相比较,醋酸浓度大,分别投入足量锌粉,开始时醋酸溶液反应速率大,因醋酸物质的量多,则完全反应生成氢气多,加水稀释时,醋酸进一步电离,则当加水稀释相同的倍数,硫酸PH变化范围大,
故答案为:=;<;>.
本题解析:
本题难度:一般
2、选择题 下列电离方程式书写不正确的是
A.2H2O H3O++OH-
H3O++OH-
B.H2S H+ + HS-
H+ + HS-
C.NaHS Na++HS-
Na++HS-
D.NaHCO3 = Na+ + HCO3-
参考答案:C
本题解析:NaHS是强电解质,电离方程式为NaHS= Na++HS-,选项C不正确,其余都是正确的,因此答案选C。
本题难度:一般
3、填空题 下列物质:(1)Na;(2)Br2;(3)Na2O;(4)N2O5;(5)CO2;(6)SO3;(7)NH3;(8)H2S;(9)HCl;(10)H2SO4;(11)Ba(OH)2固体;(12)NaCl固体;(13)蔗糖;(14)NaCl溶液中属于电解质的是______,属于非电解质的是______,能导电的是______.
参考答案:在水溶液中或熔化状态下能导电的化合物属于电解质,满足该条件达到有:(3)Na2O、(8)H2S、(9)HCl、(10)H2SO4;(11)Ba(OH)2固体;(12)NaCl固体;
非电解质在水溶液中和熔化状态下都不能导电的化合物,满足条件的有:(4)N2O5、(5)CO2、(6)SO3、(7)NH3、(13)蔗糖;
存在自由移动粒子,能够导电的物质有:(1)Na、(14)NaCl溶液;
故答案为:(3)(8)(9)(10)(11)(12);(4)(5)(6)(7)(13);(1)(14).
本题解析:
本题难度:一般
4、选择题 下列关于电解质溶液的叙述正确的是( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+)
B.稀释醋酸溶液,溶液中所有离子的浓度均降低
C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
D.0.1mol?L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
参考答案:A.常温下,在pH=7的醋酸钠和醋酸混合溶液中c(H+)=c(OH-),电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(CH3COO-)=c(Na+),故A错误;
B.稀释醋酸溶液,c(H+)减小,Kw不变,则醋酸稀释时c(OH-)增大,故B错误;
C.pH=5的溶液中c(H+)>c(OH-),由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),则c(Na+)<c(Cl-)+c(NO3-),但钠离子、氯离子均来源氯化钠的电离,则c(Na+)=c(Cl-),故C正确;
D.硫化钠溶液中,由电荷守恒可知c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),由物料守恒可知12c(Na+)=c(S2-)+c(HS-)+c(H2S),则c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C.
本题解析:
本题难度:简单
5、填空题 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)?②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)?④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是______,上述四种离子浓度的大小顺序为(填序号)______;
(2)若四种离子的关系符合③,则溶质为______;
若四种离子的关系符合④,则溶质为______;
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图1正确的是(填图象符号)______;

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)______c(NH3?H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)______c(OH-).
(5)如图2所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是______,正极反应式是______.
参考答案:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:NH4Cl;①;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,
其溶质为NH4Cl、NH3.H2O;④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和NH3?H2O;NH4Cl和HCl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,
故答案为:B;
(4)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3?H2O),
而HCl为强电解质,完全电离,NH3.H2O为弱电解质,不完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)>c(OH-),
故答案为:小于;大于;
(5)由图2可知,Zn比Cu活泼,Zn作负极,由Zn+2HCl═ZnCl2+H2↑,则正极反应为2H++2e-=H2↑,
故答案为:Zn;2H++2e-=H2↑.
本题解析:
本题难度:一般