| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》高频考点预测(2019年最新版)(二)
参考答案:C 本题解析:离子反应应是在水溶液中的反应,C项不属氧化还原反应,所以C对。 本题难度:一般 2、选择题 能正确表示下列反应的离子方程式是 |
参考答案:B
本题解析:A:两者的产物只能是碳酸氢盐,不正确
B:正确
C:水解是微弱的可逆反应:CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
D:由于铁过量,最终铁应以二价亚铁离子存在,不正确
答案为B
本题难度:一般
3、填空题 某工业废液里含有FeCl2、CuCl2和FeCl3。为回收铜并得到纯净的FeCl3溶液,现设计如下综合利用的主要流程。试推断: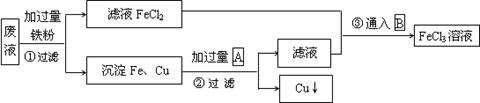
(1)方框内物质A和B的化学式:A ;B ;
(2)第③步通入B的离子方程式为 ___。
参考答案:(1) HCl Cl2 (每空1分)
(2) 2Fe2+ + Cl2 ="==" 2Fe3+ + 2Cl-(2分)
本题解析:略
本题难度:一般
4、实验题 (12分)利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下: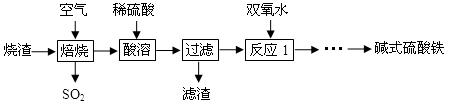
(1)SO2与过量NaOH溶液反应的离子方程式为 。
(2)滤渣的主要成分为 (填化学式)。
(3)反应1中加双氧水的目的是 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
参考答案:(1)SO2+2OH-=SO32-+H2O;(2)SiO2;(3)将Fe2+氧化为Fe3+;(4)2:5。
本题解析:(1)当NaOH过量时,与酸性氧化物发生反应,产生正盐和水,SO2与过量NaOH溶液反应的离子方程式为SO2+2OH-=SO32-+H2O;(2)硫酸厂烧渣含铁的氧化物和少量FeS及SiO2,当焙烧时,会发生反应产生Fe2O3、SO2,向其中加入稀硫酸,发生反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,原烧渣中的SiO2不能反应,也不能溶解,过滤除去,因此滤渣的主要成分为SiO2;在烧渣焙烧的过程中可能有部分FeS为完全煅烧,在酸溶时变为Fe2+留在溶液中,加入H2O2可以将溶液中的Fe2+氧化为Fe3+,得到的滤液中只含有阳离子Fe3+;(4)在1.6920 g 样品中含有的SO42-的物质的量是:n(SO42-)=2.3300 g÷233g/mol=0.01mol,向向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。该固体为Fe2O3,n(Fe2O3)=0.6400 g÷160g/mol=0.004mol,则n(Fe3+)=2n(Fe2O3)=0.008mol,由于任何化合物阳离子带的正电荷总数与阴离子带的负电荷总数相等。3 n(Fe3+)=n(OH-)+2 n(SO42-),所以n(OH-)="3" n(Fe3+)-2 n(SO42-)=3×0.008mol-2×0.01mol=0.004mol。则该碱式硫酸铁样品中的n(OH-): n(SO42-)= 0.004mol:0.01mol=2:5。
考点:考查物质制备流程的知识。主要包括离子方程式的书写、物质的成分的确定、物质的作用、化合物中微粒的个数比的确定。
本题难度:困难
5、选择题 能正确表示下列反应离子方程式的是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
C.氢氧化镁与稀盐酸反应:H++OH-=H2O
D.Ba(OH)2溶液与稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
参考答案:A
本题解析:A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O,A正确;B.Na2S2O3溶液中加入稀盐酸:S2O32-+2H+=SO2↑+3S↓+H2O,B错误;C.氢氧化镁与稀盐酸反应:2H++Mg(OH)2=2H2O+Mg2+,C错误;D.Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,D错误,答案选A。
考点:考查离子方程式正误判段
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《碳族元素》高频考.. | |