1、选择题 0.lmol/L的K2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.lmol/L。如果要使c(CO32-)更接近于0.lmol/L,可以采取的措施是(? )
A.加入少量盐酸
B.加入适量的水
C.加入适量的KOH
D.加热
参考答案:C
本题解析:A、加入少量盐酸,盐酸和碳酸根反应生成水和二氧化碳,碳酸根离子浓度减小,错误;B、加入水稀释会导致溶液中碳酸根离子浓度减小,错误;C、加入适量的KOH固体,会抑制碳酸根水解,使得碳酸根浓度接近0.1mol/L,正确;D、加热会促进碳酸根离子水解,导致离子浓度减小,错误。
本题难度:一般
2、选择题 下列说法与盐的水解有关的是? (? )
①明矾可以傲净水剂;
②实验室配制FeCl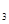 溶液时,往往在FeCl
溶液时,往往在FeCl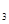 溶液中加人少量的盐酸;
溶液中加人少量的盐酸;
③用NaHCO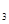 和A1
和A1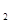 (SO
(SO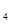 )
)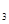 两种溶液可作泡沫灭火剂;
两种溶液可作泡沫灭火剂;
④在NH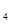 Cl溶液中加入金属镁会产生氢气;
Cl溶液中加入金属镁会产生氢气;
⑤草木灰与氨态氮肥不能混合施用;
⑥实验室盛放Na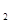 CO
CO 溶液的试剂瓶应用橡皮塞;
溶液的试剂瓶应用橡皮塞;
⑦纯碱溶液去油污;
A.①③⑥
B.②③⑤
C.③④⑤
D.全部有关
参考答案:D
本题解析:①铝离子水解生成氢氧化铝的胶体,吸附,净水;②加入盐酸,抑制水解;③发生双水解生成氢氧化铝和二氧化碳;④氯化铵水解呈酸性;⑤碳酸根与铵根双水解失效;⑥碳酸钠呈碱性,与二氧化硅反应;⑦纯碱水解呈碱性,碱性条件下油脂水解。
本题难度:简单
3、选择题
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A+)
C.V总≥20 mL
D.V总≤20 mL
参考答案:AD
本题解析:本题考查的是一元酸的pH与强碱的pOH相等的两溶液反应达中性情况的相关知识的分析。要区分一元酸、碱两溶液物质的量浓度相同时混合反应的情况。分析溶液中阴、阳离子浓度间的关系要注重离子电荷守恒的应用。
溶液中四种离子浓度间满足电荷守恒关系:c(K+)+c(H+)=c(OH-)+c(A-)因为pH=7说明溶液中c(H+)=c(OH-),反应后的混合液中共存在四种离子,因此c(A-)=c(K+);如果HA是一元强酸,则V总="20" mL,如果是弱酸,则酸的浓度大于碱的浓度,V总<20 mL。
本题难度:简单
4、选择题 在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质的是
A.硫酸镁
B.碳酸氢钠
C.氯化铝
D.盐酸溶液
参考答案:A
本题解析:A.加热促进硫酸镁水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸镁,灼烧硫酸镁,硫酸镁不分解,所以最后得到的固体仍然是硫酸镁,故A正确;B.灼烧碳酸氢钠时碳酸氢钠分解生成碳酸钠、二氧化碳和水,所以最后得到的是碳酸钠,故B错误;C.加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝,故C错误;D.盐酸有挥发性,蒸干时氯化氢和水都挥发,所以得不到固体,故D错误;
本题难度:简单
5、选择题 下列说法不正确的是
A.加热或稀释NH4Cl溶液,NH4Cl水解程度均增大
B.滴有酚酞试液的氨水中加入NH4Cl固体,溶液颜色变浅
C.含有NH4Cl的氨水中,[NH4+]可能大于[Cl-]
D.纯水中加入少量NH4Cl固体,恢复到原温度,水的电离平衡右移且电离常数变大
参考答案:D
本题解析:A、盐类的水解为吸热反应,加热NH4Cl水解程度增大,稀释NH4Cl溶液,水解程度增大,正确;B、滴有酚酞试液的氨水中加入NH4Cl固体,增加了NH4+浓度,使氨水的电离程度减小,溶液颜色变浅,正确;C、若氨水过量较多,氨水电离出NH4+,[NH4+]大于[Cl-],正确;D、加入NH4Cl,NH4+发生水解反应,恢复到原温度,水的电离平衡右移但电离常数不变,错误。
本题难度:一般