1、选择题 下列关于铷的叙述中,不正确的是( )
A.原子半径比钾的大
B.碳酸铷加热易分解为氧化铷和二氧化碳
C.氯化铷属于离子化合物
D.铷的盐类大多易溶于水
参考答案:B
本题解析:
本题难度:简单
2、选择题 R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼的非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+7
D.若X的最高正化合价为+5,则五种元素都是非金属元素
参考答案:A、同周期元素的原子,从左到右,最高价氧化物对应的水化物碱性越来越弱,若R(OH)n为强碱,W(OH)n+1不一定为强碱,故A错误;
B、同周期元素的原子,从左到右,元素的非金属性越来越强,最高价氧化物对应的水化物酸性越来越强,若HnXOm为强酸,则Y是活泼的非金属元素,故B正确;
C、若Y的最低化合价为-2,所以最外层电子数为6,则Z的最外层电子数为7,最高正化合价为+7,而氟元素无正化合价,故C错误;
D、如果R、W、X、Y、Z为原子序数依次递增的第三周期元素,若X的最高正化合价为+5,即为P,则R为金属铝,故D错误.
故选B.
本题解析:
本题难度:简单
3、简答题 图表法、图象法是常用的科学研究方法.
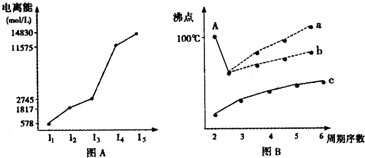
(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第______族.
II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第______族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由:______.
(2)部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |
|

|

沸点/℃
-164
-88.6
-0.5
熔点/℃
45
96
114
|
由这些数据你能得出的结论是(至少写2条):______,______.
参考答案:(1)I.电离能是元素的原子失去电子所需要的能量,根据图象可以知道,元素的第三电离能之后数据相当大,说明易失去三个电子,最外层电子数为3,故为第ⅢA的元素,故答案为:IIIA;
II.图B中元素的氢化物的沸点变化规律的图象中,折线c可以得出该族元素的氢化物的沸点随着原子序数的递增,从上到下是逐渐升高的,符合第IVA元素的性质,没有特例出现,A点所示的氢化物是水,在水中,由于在水分子间存在氢键,其沸点高于氧族元素中的其它氢化物的沸点,即曲线b符合要求,故答案为:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点;
(2)根据表中所给的物质可以看出:前三种和后四种物质均是互为同系物,发现同系物相对分子质量越大、分子间作用力越强,沸点越高,并且是当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高,故答案为:同系物相对分子质量越大、分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高).
本题解析:
本题难度:一般
4、推断题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为____________;元素T周期表中位于第_____族。
(2)J和氢组成的化合物分子有4个原子,其结构式为_________
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为__________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为__________________
②由甲与氧气、KOH溶液构成原电池,负极会产生L的单质。则其负极反应式为_________________。
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215
kJ。该反应的热化学方程式为______________________。
参考答案:(1) ;ⅦA
;ⅦA
(2)CH CH
CH
(3)AlCl3+3H2O=Al(OH)3 +3HCl↑
(4)①2NH3·H2O +3H2O2=N2+8H2O;②2NH3-6e-+6OH-= N2+6H2O
(5)CS2(1) +3O2(g) = CO2(g) +2SO2(g) △H= -1 075kJ/mol
本题解析:
本题难度:一般
5、推断题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。

(1)M的离子结构示意图为______;元素T在周期表中位于周期表_________;J和R的最高价氧化物对应的水化物的酸性较强的是_______(写化学式)。
(2)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_________。
(3)L的最简单气态氢化物甲的水溶液显碱性。 一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是____(选填序号)。
选项?
a?
b
c
d
x?
温度
温度
加入H2的物质的量?
加入甲的物质的量
y
甲的物质的量?
平衡常数K
甲的转化率
生成物物质的量总和
(4)R所在族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1
b.+29.7 mol·L-1
c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
(5)处理含JO、RO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质R。
已知:JO(g)+O2(g) = JO2(g)  H=-283.0 kJ·mol-1
H=-283.0 kJ·mol-1
R(g)+ O2(g) = RO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是__________________。
(6)某元素与R元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径______(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:___________。
参考答案:(1)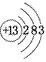 ;第3周期第ⅦA族?;H2SO4
;第3周期第ⅦA族?;H2SO4
(2)AlCl3 + 3H2O = Al(OH)3↓+ 3HCl↑
(3)a和c
(4)b?
(5)2CO(g) + SO2(g) = S(s) + 2CO2(g) △H=-270kJ/mol
(6)大;Al(OH)3 + OH- = AlO2- + 2H2O
本题解析:
本题难度:困难